Eigenschappen van elektrolyten. Sterke en zwakke elektrolyten. Elektrolyten - wat is het?
Uitstekende geleiders van elektrische stroom - goud,koper, ijzer, aluminium, legeringen. Samen met hen is er een grote groep niet-metallische stoffen, waarvan de smelt en waterige oplossingen ook de eigenschap van geleidbaarheid hebben. Dit zijn sterke basen, zuren, sommige zouten, gezamenlijk "elektrolyten" genoemd. Wat is ionische geleidbaarheid? Laten we eens kijken welke relatie elektrolyten hebben met dit wijdverspreide fenomeen.

Welke deeltjes dragen ladingen?
De wereld rondom is vol met verschillende dirigenten, en ookisolatoren. Deze eigenschappen van lichamen en stoffen zijn al sinds de oudheid bekend. De Griekse wiskundige Thales heeft ervaring met barnsteen (in het Grieks - "elektron"). Nadat hij het op zijde wreef, observeerde de wetenschapper het fenomeen van aantrekking van haar, vezels van wol. Later werd bekend dat barnsteen een isolator is. In deze stof zijn er geen deeltjes die een elektrische lading zouden kunnen dragen. Goede geleiders zijn metalen. In hun samenstelling zijn er atomen, positieve ionen en vrije, oneindig kleine negatieve deeltjes - elektronen. Ze bieden de ladingoverdracht wanneer de stroom wordt doorgegeven. Sterke elektrolyten in droge vorm bevatten geen vrije deeltjes. Maar tijdens oplossen en smelten breekt het kristalrooster, evenals de polarisatie van de covalente binding.
Water, niet-elektrolyten en elektrolyten. Wat is ontbinding?
Door elektronen te geven of te bevestigen, atomenmetalen en niet-metalen elementen worden omgezet in ionen. Tussen hen in het kristalrooster zit een redelijk sterke verbinding. Het oplossen of smelten van ionische verbindingen, bijvoorbeeld natriumchloride, leidt tot de vernietiging ervan. In polaire moleculen zijn er geen gebonden of vrije ionen, ze ontstaan wanneer ze in wisselwerking staan met water. In de jaren dertig van de negentiende eeuw ontdekte M. Faraday dat oplossingen van sommige stoffen stroom geleiden. De wetenschapper introduceerde in de wetenschap zulke belangrijke concepten:
- ionen (geladen deeltjes);
- elektrolyten (geleiders van de tweede soort);
- kathode;
- anode.
Er zijn verbindingen - sterke elektrolyten, waarvan de kristalroosters volledig afbreken door de afgifte van ionen.

Er zijn onoplosbare stoffen en dieworden bewaard in een moleculaire vorm, bijvoorbeeld suiker, formaldehyde. Dergelijke verbindingen worden niet-elektrolyten genoemd. Voor hen is de vorming van geladen deeltjes niet kenmerkend. Zwakke elektrolyten (kolen en azijnzuur, ammoniumhydroxide en een aantal andere stoffen) bevatten weinig ionen.
Theorie van elektrolytische dissociatie
In zijn werken de Zweedse wetenschapper S. Arrhenius (1859-1927) vertrouwde op de conclusies van Faraday. Later werden de bepalingen van zijn theorie verduidelijkt door de Russische onderzoekers I. Kablukov en V. Kistyakovsky. Ze ontdekten dat bij het oplossen en smelten van ionen niet alle stoffen, maar alleen elektrolyten vormen. Wat is S. Arrhenius-dissociatie? Dit is de vernietiging van moleculen, wat leidt tot het verschijnen van geladen deeltjes in oplossingen en smeltingen. De belangrijkste theoretische bepalingen van S. Arrhenius:
- De basen, zuren en zouten in oplossingen zijn in gedissocieerde vorm.
- Omkeerbare afbraak in ionen sterke elektrolyten.
- Zwakke ionen vormen weinig ionen.

De indicator van de mate van dissociatie van een stof (zijnvaak uitgedrukt als een percentage) is de verhouding van het aantal moleculen dat is vergaan tot ionen en het totale aantal deeltjes in oplossing. Elektrolyten zijn sterk als de waarde van deze indicator meer dan 30% is, in het geval van zwakke - minder dan 3%.
Eigenschappen van elektrolyten
Theoretische conclusies van S. Arrhenius werd aangevuld met latere studies van fysisch-chemische processen in oplossingen en smeltingen uitgevoerd door Russische wetenschappers. De eigenschappen van basen en zuren werden uitgelegd. De eerste omvatten verbindingen waarvan de oplossingen van kationen alleen metaalionen kunnen worden gedetecteerd, de anionen zijn de deeltjes OH-. De moleculen van zuren ontbinden in negatieve ionen van de zuurrest en waterstofprotonen (H.+). De beweging van ionen in oplossing en smelten is chaotisch. Overweeg de resultaten van het experiment, waarvoor u een ketting moet samenstellen, inclusief koolstofelektroden en een gewone gloeilamp. Laten we de geleidbaarheid van oplossingen van verschillende stoffen controleren: keukenzout, azijnzuur en suiker (de eerste twee zijn elektrolyten). Wat is een elektrisch circuit? Dit is een bron van stroom en geleiders met elkaar verbonden. Wanneer het circuit gesloten is, gloeit de lamp helderder in de zoutoplossing. De beweging van de ionen verwerft orde. De anionen zijn gericht op de positieve elektrode en de kationen op de negatieve elektrode.
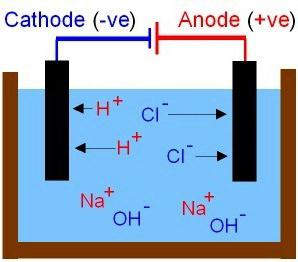
In dit proces neemt azijnzuur deeleen kleine hoeveelheid geladen deeltjes. Suiker is geen elektrolyt, het voert geen stroom uit. Tussen de elektroden in deze oplossing bevindt zich een isolerende laag, de lamp brandt niet.
Chemische interacties tussen elektrolyten
Wanneer de oplossingen worden leeggemaakt, kan worden waargenomen hoe deze leidenjezelf elektrolyten. Wat zijn de ionische vergelijkingen van soortgelijke reacties? Denk bijvoorbeeld aan de chemische interactie tussen bariumchloride en natriumnitraat:
2NaNO3 + BaCl2 + = 2NaCl + Ba (NO3)2.
De formules van elektrolyten kunnen in ionische vorm worden geschreven:
2Na+ + 2NO3 + Ba2+ + 2Cl- = 2Na+ + 2Cl- + Ba2+ + 2NO3.
De stoffen die voor de reactie worden ingenomen, zijn sterke elektrolyten. In dit geval verandert de samenstelling van de ionen niet. De chemische interactie tussen oplossingen van elektrolyten is mogelijk in drie gevallen:
1. Als een van de producten een onoplosbare stof is.
Molecuulvergelijking: Na2SO4 + BaCl2 = BaSO24 + 2NaCl.
Laten we de samenstelling van elektrolyten in de vorm van ionen schrijven:
2Na+ + ZO42- + Ba2+ + 2Cl- = BaSO24 (wit neerslag) + 2Na+ 2Cl-.
2. Een van de gevormde stoffen is gas.
3. Onder de reactieproducten bevindt zich een zwak elektrolyt.

Water is een van de zwakste elektrolyten
Chemisch zuiver water (gedestilleerd) geleidt geen elektrische stroom. Maar in zijn samenstelling is er een kleine hoeveelheid geladen deeltjes. Dit zijn protonen H+ en anionen OH-. Een verwaarloosbaar aantal watermoleculen ondergaan dissociatie. Er is een waarde - het ionproduct van water, dat constant is bij een temperatuur van 25 ° C. Het stelt iemand in staat de concentraties van H te kennen+ en OH-. Waterstofionen overheersen in oplossingen van zuren, hydroxide-anionen zijn groter in alkaliën. In neutraal - het cijfer H+ en OH-. Het oplossingsmedium karakteriseert ook de waterstofindex (pH). Hoe hoger het is, hoe meer hydroxide-ionen aanwezig zijn. Het medium is neutraal bij een pH-bereik dichtbij 6-7. In aanwezigheid van H-ionen+ en OH- verander hun kleurindicatoren: lakmoes, fenolftaleïne, methylorange en anderen.
Eigenschappen van oplossingen en smeltingen van elektrolytenworden veel gebruikt in de industrie, engineering, landbouw en geneeskunde. De wetenschappelijke rechtvaardiging is vastgelegd in de werken van een aantal opmerkelijke wetenschappers die het gedrag van deeltjes hebben uitgelegd, waarvan zouten, zuren en basen zijn samengesteld. In hun oplossingen vindt een verscheidenheid aan ionenuitwisselingsreacties plaats. Ze worden gebruikt in veel industriële processen, in elektrochemie, galvanisatie. Processen in levende wezens komen ook voor tussen oplossingen in ionen. Veel niet-metalen en metalen, giftig in de vorm van atomen en moleculen, zijn onmisbaar in de vorm van geladen deeltjes (natrium, kalium, magnesium, chloor, fosfor en andere).



