De ervaring van Rutherford
Ernest Rutherford - uniek, zeer getalenteerden een zeer ongebruikelijke wetenschapper. Opgemerkt moet worden dat de belangrijkste ontdekkingen werden gedaan nadat hij de Nobelprijs had ontvangen. In 1911 slaagde deze man erin Rutherford te ervaren (net zoals hij later werd genoemd), waardoor hij in het atoom kon kijken en een idee kon krijgen van hoe het is gerangschikt.
Talrijke experimenten met atomen werden uitgevoerden eerder. Hun belangrijkste idee was om voldoende informatie te verzamelen uit verschillende hoeken van de afwijking van de deeltjes, waardoor er een mogelijkheid zou zijn om iets concreets te zeggen over de structuur van het atoom. Aan het begin van de 20e eeuw waren wetenschappers al overtuigd dat het elektronen bevatte die negatief geladen waren. Het meest wijdverspreide in die tijd was echter het idee dat het atoom vergelijkbaar is met een positief geladen dun raster, dat is gevuld met elektronen met een negatieve lading. Dit model werd het 'rooster met rozijnen' genoemd.
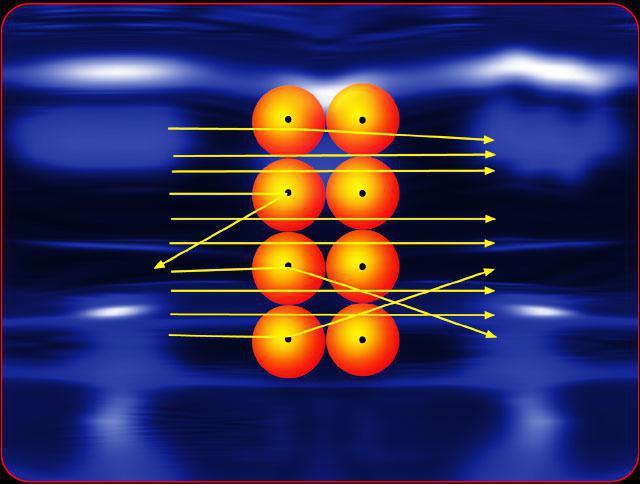
De ervaring van Rutherford was uniek. De wetenschapper bouwde een kanon, dat een gerichte en gerichte stroom deeltjes gaf. Het leek op een loden doos, waarin een nauwe spleet zat. Binnenin werd radioactief materiaal geplaatst. De alfadeeltjes die door de radioactieve stof in alle richtingen werden uitgezonden behalve één werden door het scherm van de leiding geabsorbeerd en alleen door de gleuf vloog een duidelijk gerichte deeltjesbundel naar buiten. Onderweg werden vervolgens nog verschillende schermen met sleuven geïnstalleerd die deeltjes afsnijden die afwijken van de gewenste richting. Als resultaat van dit experiment van Rutherford vloog een gefocuste bundel deeltjes naar het doelwit, het doelwit zelf was een heel dun stuk folie. Daarin, en druk op de alpha-straal.
Nadat de alfadeeltjes botstenatomen folie ze liepen door en uiteindelijk bevonden zich op het fosforscherm die is geïnstalleerd achter het doel. Wanneer de deeltjes het scherm getroffen, de flitser daarop geregistreerde, waarop een experimentator kan beoordelen hoe en in welke hoeveelheid alfa-deeltjes worden afgebogen van de rechte bewegingsrichting door botsingen met atomen van goudfolie.
De ervaring van Rutherford was zo origineel,dat niemand voor hem heeft geprobeerd te controleren of bepaalde deeltjes in grote hoeken afwijken. Het oude rastermodel stond zelfs het bestaan van dergelijke zware en dichte elementen in het atoom niet toe dat ze zeer snelle alfadeeltjes bij voldoende grote hoeken konden afwijzen.
De ervaring van Rutherford maakte het mogelijk om te concluderen dat een groteeen deel van de massa is geconcentreerd in een zeer dichte substantie, die zich in het centrum van het atoom bevindt. De rest was eigenlijk veel minder dicht dan het eerder leek. Het Rutherford-atoom bevatte een superdensecentrum, dat de kern werd genoemd, waarin overigens de positieve lading was geconcentreerd.
De foto van het atoom, die de wetenschapper tekende, voor onsnu bekend. Het model van Rutherford bestaat uit het feit dat er in het midden een atoomkern is met een positieve lading, waarin de gehele massa van het atoom is geconcentreerd. Over het algemeen is het atoom neutraal. Daarom is het aantal elektronen binnen, zoals de lading van de kern, gelijk aan het aantal van het element in het periodieke systeem. Het is duidelijk dat de elektronen niet in het atoom kunnen rusten, omdat ze eenvoudig op de kern vallen. Ze bewegen er omheen op dezelfde manier als de planeten rond het licht van de zon draaien.
Dit type beweging wordt bepaald door de acties van krachtenDe hanger aan de kant van de kern. Atomen zijn stabiel, in een niet-bestudeerde staat kunnen ze lang mee gaan zonder elektromagnetische golven uit te zenden. Het planetaire model van het atoom, hoewel het experimenteel gerechtvaardigd is, staat ons echter niet toe om uit te leggen waarom het stabiel is.