Eiwit-enzym: de rol, eigenschappen, functie van proteïne-enzymen in het lichaam
In elke levende cel zijn er veelchemische reacties. Enzymen (enzymen) zijn eiwitten met speciale en extreem belangrijke functies. Ze worden biokatalysatoren genoemd. De belangrijkste functie van proteïne-enzymen in het lichaam is het versnellen van biochemische reacties. De initiële reagentia waarvan de interactie door deze moleculen wordt gekatalyseerd, worden substraten genoemd en de uiteindelijke verbindingen zijn producten.
In de natuur werken enzymeiwitten alleen in de levendensystemen. Maar in de moderne biotechnologie, klinische diagnostiek, farmacie en geneeskunde gebruikt gezuiverde enzymen of hun complexen, evenals extra componenten die nodig zijn voor de werking van het systeem en data visualisatie voor de onderzoeker.
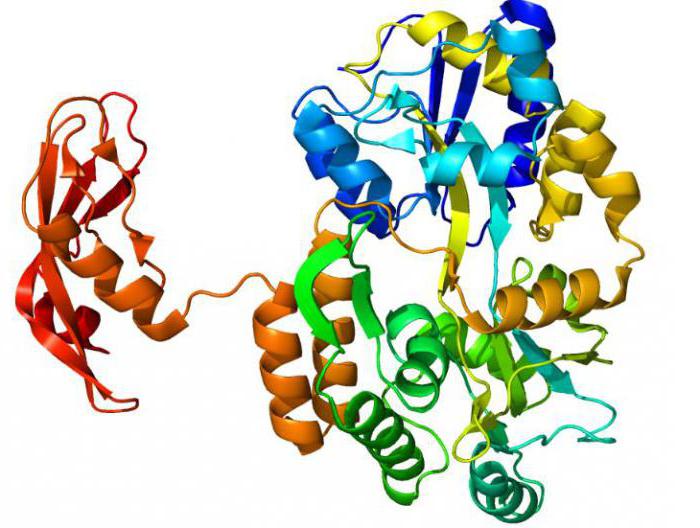
Biologische betekenis en eigenschappen van enzymen
Zonder deze moleculen zou een levend organisme dat niet kunnenom te functioneren. Alle levensprocessen werken samen dankzij enzymen. De belangrijkste functie van proteïne-enzymen in het lichaam is de regulatie van het metabolisme. Zonder hen is normaal metabolisme onmogelijk. Regulering van de activiteit van moleculen vindt plaats onder de werking van activatoren (inductoren) of remmers. Controle werkt op verschillende niveaus van eiwitsynthese. Hij "werkt" ook voor een al klaar molecuul.
De belangrijkste eigenschappen van proteïne-enzymen -specificiteit voor een specifiek substraat. En dienovereenkomstig, het vermogen om slechts één of, meer zeldzaam, een reeks reacties te katalyseren. Meestal zijn dergelijke processen omkeerbaar. Beide enzymen zijn verantwoordelijk voor beide functies. Maar dat is niet alles.
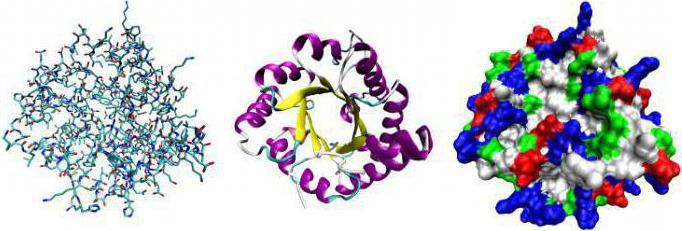
De rol van proteïne-enzymen is essentieel. Zonder hen komen geen biochemische reacties voor. Door de werking van enzymen is het mogelijk voor reagentia om de activeringsbarrière te overwinnen zonder significant energieverbruik. In het lichaam is het niet mogelijk om de temperatuur te verwarmen boven 100 ° C of agressieve componenten zoals een chemisch laboratorium te gebruiken. Het proteïne-enzym combineert met het substraat. In de gebonden toestand is er een modificatie gevolgd door de release van de laatste. Dit is hoe alle katalysatoren die bij de chemische synthese worden gebruikt werken.
Wat zijn de organisatieniveaus van het eiwit-enzymmolecuul?
Gewoonlijk hebben deze moleculen een tertiair (bolletje) ofquaternaire (verschillende verbonden globules) eiwitstructuur. Eerst worden ze gesynthetiseerd in een lineaire vorm. En vouw vervolgens in de gewenste structuur. Om activiteit te garanderen, heeft de biokatalysator een bepaalde structuur nodig.
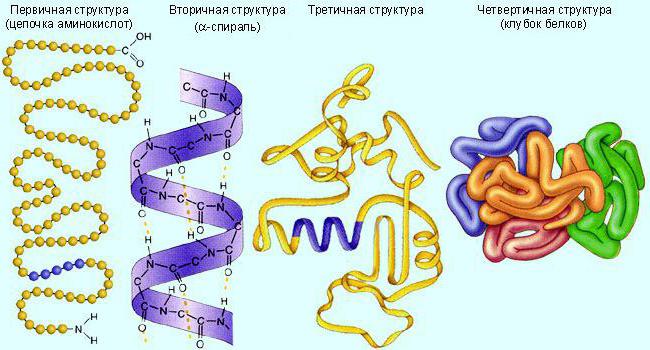
Enzymen worden, net als andere eiwitten, vernietigd door verhitting, extreme pH-waarden, agressieve chemische verbindingen.
Extra eigenschappen van enzymen
Onder hen worden de volgende kenmerken van de componenten onderscheiden:
- Stereospecificity - de vorming van slechts één product.
- Regioselectiviteit is het verbreken van de chemische binding of de modificatie van de groep in slechts één positie.
- Chemoselectiviteit is de katalyse van slechts één reactie.
Kenmerken van werk
Het niveau van specificiteit van enzymen varieert. Maar elk enzym is altijd actief met betrekking tot een bepaald substraat of een groep verbindingen die qua structuur vergelijkbaar zijn. Niet-eiwitkatalysatoren hebben deze eigenschap niet. De specificiteit wordt gemeten door de bindingsconstante (mol / l), die 10 kan bereiken-10 mol / l. Het werk van het actieve enzym is snel. Eén molecuul katalyseert duizenden miljoenen bewerkingen per seconde. De mate van versnelling van biochemische reacties is significant (1000 - 100.000 keer) hoger dan die van conventionele katalysatoren.
De werking van enzymen is op meerdere gebouwdmechanismen. De eenvoudigste interactie vindt plaats met één molecuul van het substraat, gevolgd door de vorming van een product. De meeste enzymen kunnen 2-3 verschillende moleculen binden die in de reactie terechtkomen. Bijvoorbeeld de overdracht van een groep of atoom van de ene naar de andere verbinding of een dubbele vervanging op het principe van 'ping-pong'. Bij deze reacties is gewoonlijk één substraat verbonden en is het tweede gebonden via een functionele groep aan het enzym.
Het werkingsmechanisme van het enzym wordt bestudeerd met behulp van de volgende methoden:
- Definities van tussen- en eindproducten.
- Studies van de geometrie van de structuur en functionele groepen geassocieerd met het substraat en zorgen voor een hoge reactiesnelheid.
- Mutaties van de enzymgenen en bepalen van veranderingen in de synthese en activiteit.
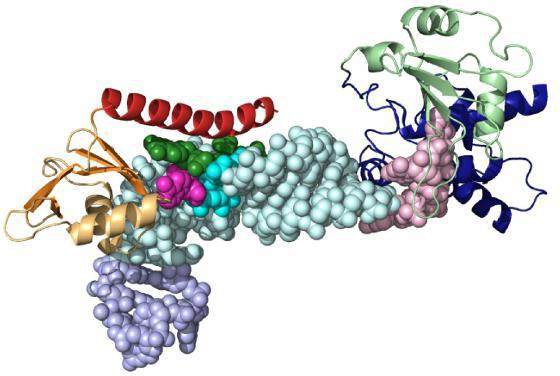
Actief en bindend centrum
Het molecuul van het substraat is veel kleiner in omvang,dan eiwitenzym. Daarom is de binding wordt veroorzaakt door een klein aantal functionele groepen van de biokatalysator. Zij vormen de actieve site, bestaande uit een specifieke set van aminozuren. In complexe eiwitten in de structuur van de prosthetische groep niet-proteïne aard, die ook deel uitmaken van het actieve centrum zijn.
Het is noodzakelijk om een afzonderlijke groep enzymen te selecteren. Ze hebben in het molecuul omvat het co-enzym permanent bindende molecuul en zijn vrijgesteld van het. Volledig gevormde eiwit holo enzym, en bij het verwijderen van een cofactor - apo-enzym. Coenzymes treden vaak vitaminen, metalen, derivaten van stikstofbasen (NAD - nicotinamide adenine dinucleotide, FAD - flavineadeninedinucleotide, FMN - flavine mononucleotide).

Het bindcentrum biedt specificiteitaffiniteit voor het substraat. Hierdoor wordt een stabiel substraat-enzymcomplex gevormd. De structuur van de bolletje is zo geconstrueerd dat er op het oppervlak een nis (spleet of holte) van een bepaalde grootte is, die de binding van het substraat verzekert. Deze zone bevindt zich meestal niet ver van het actieve centrum. Individuele enzymen hebben plaatsen voor binding aan co-factoren of metaalionen.
conclusie
Het proteïne-enzym speelt een belangrijke rol in het lichaam. Dergelijke stoffen katalyseren chemische reacties, zijn verantwoordelijk voor het metabole proces - metabolisme. In elke levende cel vinden voortdurend honderden biochemische processen plaats, inclusief de reductieve reacties, splitsing en synthese van verbindingen. Oxidatie van stoffen met een grote hoeveelheid energie vindt constant plaats. Het wordt op zijn beurt besteed aan de vorming van koolhydraten, eiwitten, vetten en hun complexen. De splitsingproducten zijn de structurele elementen voor de synthese van de noodzakelijke organische verbindingen.






