Structuur en eigenschappen van moleculen
Alle lichamen om ons heen bestaan uit atomen. Atomen worden op hun beurt weer tot een molecuul samengevoegd. Het is vanwege het verschil in moleculaire structuur dat we kunnen praten over stoffen die van elkaar verschillen, afhankelijk van hun eigenschappen en parameters. Moleculen en atomen zijn altijd in een staat van dynamiek. Terwijl ze bewegen, verspreiden ze zich nog steeds niet in verschillende richtingen, maar worden ze in een bepaalde structuur gehouden, dan dat we verplicht zijn tot het bestaan van zo'n enorme verscheidenheid aan substanties in de wereld om ons heen. Wat zijn deze deeltjes en wat zijn hun eigenschappen?
Algemene concepten
Als we uitgaan van de theorie van de kwantummechanica, bestaat het molecuul niet uit atomen, maar uit hun kernen en elektronen, die voortdurend met elkaar interageren.
Voor sommige stoffen is het molecuul het kleinsteen deeltje dat de samenstelling en chemische eigenschappen van de stof zelf heeft. De eigenschappen van moleculen vanuit het oogpunt van chemie worden dus bepaald door de chemische structuur en samenstelling. Maar alleen voor stoffen met een moleculaire structuurregel: de chemische eigenschappen van stoffen en moleculen zijn hetzelfde. Voor sommige polymeren, bijvoorbeeld ethyleen en polyethyleen, komt de samenstelling niet overeen met de moleculaire.
Het is bekend dat de eigenschappen van moleculen niet worden bepaaldalleen het aantal atomen, hun type, maar ook de configuratie, de volgorde van de verbinding. Een molecuul is een complexe architecturale constructie, waarbij elk element op zijn plaats staat en zijn eigen specifieke buren heeft. De atomaire structuur kan meer of minder stijf zijn. Elk atoom oscilleert ten opzichte van zijn evenwichtspositie.

Configuratie en instellingen
Het gebeurt dat sommige delen van het molecuul roteren ten opzichte van andere delen. In het proces van thermische beweging verkrijgt een vrij molecuul bizarre vormen (configuraties).
Over het algemeen worden de eigenschappen van moleculen bepaald door de binding(zijn type) tussen de atomen en de architectuur van het molecuul zelf (structuur, vorm). Dus, in de eerste plaats houdt de algemene chemische theorie rekening met chemische bindingen en is gebaseerd op de eigenschappen van atomen.
Met een sterk geprononceerde polariteit, de eigenschappen van de moleculenHet is moeilijk om twee- of drieconstante correlaties te beschrijven, die uitstekend zijn voor niet-polaire moleculen. Daarom werd een extra parameter met een dipoolmoment geïntroduceerd. Maar deze methode is niet altijd succesvol, omdat polaire moleculen individuele kenmerken hebben. Parameters voor het administreren van kwantumeffecten die belangrijk zijn bij lage temperaturen zijn ook voorgesteld.

Wat weten we over de molecule van de meest voorkomende stof op aarde?
Van alle stoffen op onze planeet, het meestgebruikelijk is water. Zij geeft in letterlijke zin leven aan alle dingen op aarde. Alleen virussen kunnen het zonder, de rest van de levende structuren in zijn samenstelling heeft meestal water. Welke eigenschappen van het watermolecuul, die er alleen maar toe doen, worden gebruikt in het economische leven van de mens en de levende aard van de aarde?
Immers, dit is echt een unieke substantie! Een reeks eigenschappen die inherent zijn aan water, kan niet bogen op meer substantie.
Water is het belangrijkste oplosmiddel in de natuur. Alle reacties die in levende organismen voorkomen, komen op de een of andere manier voor in het aquatisch milieu. Dat wil zeggen, de substanties komen in reacties binnen en bevinden zich in een opgeloste toestand.
Water heeft een uitstekende warmtecapaciteit maar is laagthermische geleidbaarheid. Dankzij deze eigenschappen kunnen we het gebruiken als een transport van warmte. Dit principe is opgenomen in het koelingsmechanisme van een groot aantal organismen. In atoomenergie waren de eigenschappen van een watermolecuul de reden om deze stof als koelmiddel te gebruiken. Naast de mogelijkheid om een reactief medium voor andere stoffen te zijn, kan water zelf reageren: fotolyse, hydratatie en andere.

Natuurlijk zuiver water is vloeibaar, geurloos, kleurloos en smaakloos. Maar bij een laagdikte van meer dan 2 meter wordt de kleur blauwachtig.
Het gehele watermolecuul is een dipool (twee tegengestelde polen). Het is de dipoolstructuur die voornamelijk de ongebruikelijke eigenschappen van deze stof bepaalt. Het watermolecuul is diamagnetisch.
Een andere interessante woning heeft Talayawater: zijn molecuul verwerft de structuur van de gouden verhouding, en de structuur van de materie - de verhoudingen van de gouden sectie. Veel eigenschappen die een watermolecuul bezit, worden vastgesteld door de absorptie en emissie van gestreepte spectra in de gasfase te analyseren.
Natuurlijke en moleculaire eigenschappen
Alle stoffen, behalve chemische, hebben fysische eigenschappen van de moleculen die in hun structuur binnenkomen.
In de fysica wordt het concept van moleculen gebruiktverklaringen van de eigenschappen van vaste stoffen, vloeistoffen en gassen. Het vermogen van alle stoffen om te diffunderen, hun viscositeit, thermische geleidbaarheid en andere eigenschappen worden bepaald door de mobiliteit van moleculen. Toen de Franse fysicus Jean Perrin de Brownse beweging bestudeerde, bewees hij experimenteel het bestaan van moleculen. Alle levende organismen bestaan dankzij een fijn gebalanceerde interne interactie in de structuur. Alle chemische en fysische eigenschappen van stoffen zijn van fundamenteel belang voor de natuurwetenschap. De ontwikkeling van natuurkunde, scheikunde, biologie en moleculaire fysica heeft de opkomst van een wetenschap als moleculaire biologie gediend, en de belangrijkste verschijnselen in het leven onderzocht.
Gebruikmakende van statistische thermodynamica,De fysische eigenschappen van moleculen, die worden bepaald door de methoden van moleculaire spectroscopie, in de fysische chemie bepalen de thermodynamische eigenschappen van stoffen die nodig zijn voor de berekening van chemische evenwichten en de snelheid waarmee ze tot stand komen.

Wat is het verschil tussen de eigenschappen van atomen en moleculen?
Ten eerste worden atomen niet gevonden in de vrije staat.
Moleculen hebben rijkere optische spectra. Dit komt door de lagere symmetrie van het systeem en de komst van de mogelijkheid van nieuwe rotaties en oscillaties van de kernen. In een molecuul bestaat de totale energie uit drie energieën, die verschillen in de orde van grootte van de componenten:
- elektronenschil (optische of ultraviolette straling);
- oscillaties van kernen (infrarood deel van het spectrum);
- rotatie van het molecuul als geheel (radiofrequentiebereik).
Atomen zenden karakteristieke lijnspectra uit en de moleculen zijn gestreept, bestaande uit vele dicht bij elkaar gelegen lijnen.
Spectrale analyse
Optisch, elektrisch, magnetisch en andersde eigenschappen van het molecuul worden ook bepaald door de verbinding met de golffuncties. Gegevens over de toestanden van moleculen en de waarschijnlijke overgang ertussen tonen moleculaire spectra.
Overgangen (elektronisch) in moleculen laten zienchemische bindingen en de structuur van hun elektronenschillen. Spectra met een groter aantal bindingen hebben absorptiestroken met lange golflengte die in het zichtbare gebied vallen. Als een stof uit dergelijke moleculen is opgebouwd, heeft deze een karakteristieke kleur. Dit zijn allemaal organische kleurstoffen.
Eigenschappen van moleculen van dezelfde stofzijn hetzelfde in alle aggregatietoestanden. Dit betekent dat voor dezelfde stoffen de eigenschappen van moleculen van vloeibare, gasvormige stoffen niet verschillen van de eigenschappen van vaste stof. Een molecuul van één stof heeft altijd dezelfde structuur, ongeacht de aggregatietoestand van de stof zelf.

Elektrische specificaties
Hoe een stof zich gedraagt in een elektrisch veld wordt bepaald door de elektrische eigenschappen van de moleculen: polariseerbaarheid en een constant dipoolmoment.
Het dipoolmoment is de elektrische asymmetrie van het molecuul. In moleculen met een symmetriecentrum, zoals H2er is geen constant dipoolmoment. Het vermogen van de elektronenschil van een molecuul om onder invloed van een elektrisch veld te bewegen, waardoor een geïnduceerd dipoolmoment daarin wordt gevormd, is polariseerbaarheid. Om de waarde van de polariseerbaarheid en het dipoolmoment te vinden, is het noodzakelijk om de diëlektrische constante te meten.
AC elektrisch veldgedragLichtgolven karakteriseren de optische eigenschappen van een stof, die worden bepaald door de polariseerbaarheid van het molecuul van deze stof. Rechtstreeks geassocieerd met polariseerbaarheid: verstrooiing, breking, optische activiteit en andere verschijnselen van moleculaire optica.
Je hoort vaak de vraag: "Wat zijn, naast moleculen, afhankelijk van de eigenschappen van een stof?" Het antwoord is vrij eenvoudig.
De eigenschappen van stoffen worden, naast isometrie en de kristalstructuur, bepaald door de omgevingstemperatuur, de stof zelf, druk en de aanwezigheid van onzuiverheden.

Molecule chemie
Voor de vorming van zo'n wetenschap als quantummechanica, de aard van chemische bindingen in moleculen was een onopgelost mysterie. De klassieke fysica kon de richting en de verzadigbaarheid van valentiebindingen niet verklaren. Na het creëren van de theoretische basisinformatie over de chemische binding (1927) met het voorbeeld van de eenvoudigste H2-molecule, begonnen de theorie en berekeningsmethoden geleidelijk te verbeteren. Op basis van het wijdverspreide gebruik van de moleculaire orbitalenmethode, de kwantumchemie, werd het bijvoorbeeld mogelijk om de interatomaire afstanden, de energie van moleculen en chemische bindingen, de verdeling van elektronendichtheid en andere gegevens die volledig samenvielen met de experimentele afstanden te berekenen.
Stoffen met dezelfde samenstelling, maar met een verschillende chemische structuur en verschillende eigenschappen, worden structurele isomeren genoemd. Ze hebben verschillende structurele formules, maar dezelfde moleculaire formules.
Verschillende soorten structurele isomerie zijn bekend. De verschillen zijn in de structuur van het koolstofskelet, de positie van de functionele groep of de positie van een meervoudige binding. Daarnaast zijn er nog steeds ruimtelijke isomeren, waarbij de eigenschappen van een stoffenmolecuul worden gekenmerkt door dezelfde samenstelling en chemische structuur. Daarom hebben ze dezelfde structurele en moleculaire formules. De verschillen liggen in de ruimtelijke vorm van het molecuul. Gebruik voor het imago van verschillende ruimtelijke isomeren speciale formules.
Er zijn verbindingen die homologen worden genoemd. Ze zijn qua structuur en eigenschappen vergelijkbaar, maar verschillen in samenstelling door een of meerdere CH2-groepen. Alle stoffen met dezelfde structuur en eigenschappen worden gecombineerd in homologe reeksen. Nadat je de eigenschappen van één homoloog hebt bestudeerd, kun je ruzie maken over elk ander. De verzameling homologen is een homologe reeks.
In de transformatie van structuren van de chemische stofmoleculaire eigenschappen veranderen drastisch. Een voorbeeld zijn zelfs de eenvoudigste verbindingen: methaan, zelfs met één zuurstofatoom gecombineerd, wordt een giftige vloeistof met de naam methanol (methylalcohol - СН3ОН). Dienovereenkomstig worden de chemische complementariteit en werking ervan op levende organismen anders. Vergelijkbare, maar complexere veranderingen treden op wanneer de structuren van biomoleculen worden gewijzigd.
Chemische moleculaire eigenschappen zijn sterk afhankelijkvan de structuur en eigenschappen van moleculen: van de energiebindingen erin en de geometrie van het molecuul zelf. Dit werkt vooral in biologisch actieve verbindingen. Welke concurrerende reactie de overhand zal hebben, wordt vaak alleen bepaald door ruimtelijke factoren, die op hun beurt weer afhangen van de oorspronkelijke moleculen (hun configuratie). Eén molecuul met een "onaangename" configuratie zal helemaal niet reageren en de andere, met dezelfde chemische samenstelling maar met een andere geometrie, kan onmiddellijk op de reactie reageren.
Een groot aantal biologische processenwaargenomen tijdens groei en voortplanting, vanwege de geometrische verhoudingen tussen de reactieproducten en uitgangsmaterialen. Ter informatie: het effect van een aanzienlijke hoeveelheid nieuwe geneesmiddelen is gebaseerd op de vergelijkbare structuur van moleculen van elke verbinding die biologisch schadelijk is voor het menselijk lichaam. Het medicijn neemt de plaats in van het schadelijke molecuul en bemoeilijkt de werking ervan.
Met behulp van chemische formules drukt u de compositie eneigenschappen van moleculen van verschillende stoffen. Op basis van het moleculair gewicht, chemische analyse, wordt een atoomverhouding vastgesteld en een empirische formule samengesteld.
geometrie
Bepaling van de geometrische structuur van het molecuulgeproduceerd met inachtneming van de evenwichtssamenstelling van atoomkernen. De energie van interactie van atomen hangt af van de afstand tussen de atoomkernen. Op zeer grote afstanden is deze energie nul. Wanneer atomen elkaar naderen, begint zich een chemische binding te vormen. Dan zijn de atomen sterk aangetrokken tot elkaar.
Als er een zwakke aantrekking is, dande vorming van een chemische binding is niet noodzakelijk. Als atomen dichterbij komen, beginnen elektrostatische afstotende krachten te werken tussen de kernen. Een obstakel voor de sterke convergentie van atomen is de onverenigbaarheid van hun innerlijke elektronenschillen.
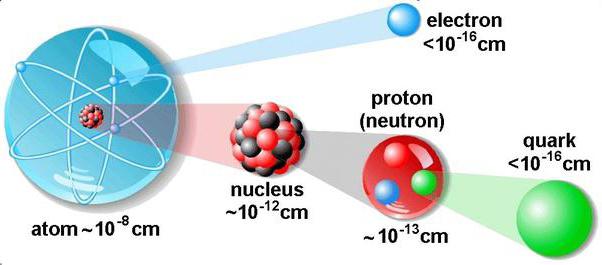
afmeting
Het is onmogelijk om moleculen met het blote oog te zien. Ze zijn zo klein dat zelfs een microscoop met een vergroting van 1000x ons niet helpt ze te zien. Biologen observeren 0,001 mm bacteriën. Maar moleculen zijn honderden en duizenden keren kleiner.
Vandaag de structuur van de moleculen van een bepaalde stofbepaald door diffractiemethoden: diffractie van neutronen, röntgenstralingsstructurele analyse. Er is ook een vibratiespectroscopie en een elektronen paramagnetische methode. De keuze van de methode hangt af van het type stof en de toestand ervan.
De grootte van een molecuul is een voorwaardelijke hoeveelheid indienhoud rekening met de elektronische schaal. Het gaat om de afstanden van elektronen tot atoomkernen. Hoe groter ze zijn, hoe minder waarschijnlijk het is om de elektronen van het molecuul te vinden. In de praktijk kan de grootte van de moleculen worden bepaald door de evenwichtsafstand te beschouwen. Dit is het gat waar de moleculen zelf naar kunnen convergeren wanneer ze strak in een moleculair kristal en in een vloeistof zijn verpakt.
Positie moleculen over grote afstanden naaraantrekking en klein, integendeel, tot afstoting. Daarom helpt röntgenanalyse van moleculaire kristallen om de grootte van het molecuul te vinden. Met behulp van de diffusiecoëfficiënt, thermische geleidbaarheid en viscositeit van gassen, evenals de dichtheid van een stof in een gecondenseerde staat, kan men de orde van grootte van moleculaire grootten bepalen.



