Biochemie van enzymen. Structuur, eigenschappen en functies
In de cel van een levend organismemiljoenen chemische reacties. Elk van hen is van groot belang, daarom is het belangrijk om de snelheid van biologische processen op een hoog niveau te houden. Bijna elke reactie wordt gekatalyseerd door zijn enzym. Wat zijn enzymen? Wat is hun rol in de cel?
Enzymen. definitie
De term "enzym" komt van het Latijnse fermentum - zuurdesem. Ze kunnen ook enzymen worden genoemd van het Grieks en zyme - "in gist."
Enzymen zijn biologisch actieve stoffen,dus elke reactie die in de cel plaatsvindt, doet niet zonder hun deelname. Deze stoffen werken als katalysatoren. Dienovereenkomstig heeft elk enzym twee basiseigenschappen:
1) Enzym versnelt de biochemische reactie, maar het wordt niet geconsumeerd.
2) De grootte van de evenwichtsconstante verandert niet, maar alleen de versnelling van deze waarde wordt versneld.
Enzymen versnellen biochemische reacties in duizend,en in sommige gevallen een miljoen keer. Dit betekent dat bij afwezigheid van een enzymatisch apparaat, alle intracellulaire processen praktisch zullen stoppen en de cel zelf zal sterven. Daarom is de rol van enzymen als biologisch actieve stoffen groot.
Verschillende enzymen zorgen voor diversificatiereguleren celmetabolisme. In elke cascade van reacties nemen veel enzymen van verschillende klassen deel. Biologische katalysatoren zijn zeer selectief vanwege een bepaalde conformatie van het molecuul. Omdat enzymen in de meeste gevallen van proteïneaard zijn, bevinden ze zich in een tertiaire of quaternaire structuur. Dit wordt opnieuw verklaard door de specificiteit van het molecuul.

Functies van enzymen in de cel
De hoofdtaak van het enzym is de versnelling van de overeenkomstige reactie. Elke cascade van processen, van de ontleding van waterstofperoxide tot glycolyse, vereist de aanwezigheid van een biologische katalysator.
Het juiste enzymwerk wordt bereikt door een hoge concentratiespecificiteit voor een bepaald substraat. Dit betekent dat een katalysator alleen een specifieke reactie kan versnellen en niet meer, zelfs een zeer vergelijkbare. Afhankelijk van de mate van specificiteit, worden de volgende groepen enzymen onderscheiden:
1) Enzymen met absolute specificiteit, wanneer slechts één enkele reactie wordt gekatalyseerd. Collagenase splitst bijvoorbeeld collageen en maltase klieft maltose.
2) Enzymen met relatieve specificiteit. Dit omvat stoffen die een bepaalde klasse van reacties kunnen katalyseren, bijvoorbeeld hydrolytische splitsing.
Het werk van de biokatalysator begint vanaf het momenthet actieve centrum met het substraat verbinden. Tegelijkertijd praten ze over complementaire interactie, zoals een slot en een sleutel. Hier hebben we het volledige samenvallen van de vorm van het actieve centrum met het substraat in gedachten, wat het mogelijk maakt om de reactie te versnellen.
De volgende stap is de reactie zelf. De snelheid neemt toe als gevolg van de werking van het enzymatische complex. Uiteindelijk krijgen we een enzym dat geassocieerd is met de reactieproducten.
De laatste fase is het loslaten van de reactieproducten van het enzym, waarna het actieve centrum weer vrij komt voor het volgende werk.
Schematisch kan het werk van het enzym in elke fase worden geschreven als:
1) S + E -> SE
2) SE -> SP
3) SP -> S + P, waarbij S het substraat is, E het enzym is en P het product is.

Classificatie van enzymen
Bij mensen kun je een enorme vindenhoeveelheid enzymen. Alle kennis over hun functies en werk was gesystematiseerd, en als gevolg daarvan kwam er een enkele classificatie naar voren, waardoor men gemakkelijk kan bepalen waarvoor een bepaalde katalysator is bedoeld. Hier zijn 6 basisklassen van enzymen, evenals voorbeelden van enkele subgroepen.
- Oxidoreductase.
Enzymen van deze klasse katalyseren redoxreacties. Er zijn in totaal 17 subgroepen. Oxidoreductasen hebben gewoonlijk een niet-eiwitgedeelte dat wordt weergegeven door een vitamine of heem.
De volgende subgroepen worden vaak gevonden onder oxidoreductasen:
a) Dehydrogenase. Biochemie van enzymen-dehydrogenases is de eliminatie van waterstofatomen en deze overbrengen naar een ander substraat. Deze subgroep komt het meest voor in reacties van respiratie, fotosynthese. In de samenstelling van dehydrogenasen is co-enzym noodzakelijkerwijs aanwezig in de vorm van NAD / NADP of flavoproteïnen FAD / FMN. Vaak zijn er metaalionen. Voorbeelden omvatten enzymen zoals cytochroomreductase, pyruvaatdehydrogenase, isocitraatdehydrogenase, evenals veel leverenzymen (lactaatdehydrogenase, glutamaatdehydrogenase, enz.).
b) Oxidasen. Een aantal enzymen katalyseert de toevoeging van zuurstof aan waterstof, met als resultaat dat de reactieproducten water of waterstofperoxide kunnen zijn (H20, H202). Voorbeelden van enzymen: cytochroomoxidase, tyrosinase.
c) Peroxidasen en catalasen - enzymen die de afbraak van H katalyseren2O2 op zuurstof en water.
d) Oxygenasen. Deze biokatalysatoren versnellen de hechting van zuurstof aan het substraat. Dopaming hydroxylase is een voorbeeld van dergelijke enzymen.
2. Transferase.
De taak van deze groep enzymen is om radicalen van een donorsubstantie over te dragen aan een ontvangende substantie.
a) Methyltransferase. DNA-methyltransferase - de belangrijkste enzymen die het proces van DNA-replicatie regelen. Nucleotide methylatie speelt een grote rol in de regulatie van nucleïnezuur.
b) Acyltransferase. Enzymen van deze subgroep transporteren een acylgroep van het ene molecuul naar het andere. Voorbeelden van acyltransferase zijn: lecithine-cholesterol-acyltransferase (overdracht van functionele groep van vetzuur naar cholesterol), lysofosfatidylcholine-acyltransferase (acylgroep wordt overgebracht naar lysofosfatidylcholine).
c) Aminotransferasen - enzymen die hierbij betrokken zijnbij de omzetting van aminozuren. Voorbeelden van enzymen: alanine-aminotransferase, dat de synthese van alanine uit pyruvaat en glutamaat katalyseert door een aminogroep over te dragen.
d) Fosfotransferase. Enzymen van deze subgroep katalyseren de toevoeging van een fosfaatgroep. Een andere naam voor fosfotransferase, kinase, komt veel vaker voor. Voorbeelden omvatten enzymen zoals hexokinase en aspartaatkinase, die fosforresiduen aan hexosen (meestal aan glucose) en aan asparaginezuur respectievelijk binden.
3. Hydrolasen - een klasse van enzymen die de splitsing van bindingen in een molecuul katalyseren, gevolgd door de toevoeging van water. Stoffen die tot deze groep behoren, zijn de belangrijkste enzymen voor de spijsvertering.
a) Esterase - breek de etherbindingen. Een voorbeeld zijn lipasen die vetten afbreken.
b) Glycosidase. De biochemie van enzymen van deze reeks bestaat uit de vernietiging van de glycosidebindingen van polymeren (polysacchariden en oligosacchariden). Voorbeelden: amylase, sucrase, maltase.
c) Peptidasen - enzymen die de afbraak van eiwitten tot aminozuren katalyseren. Peptidasen omvatten enzymen zoals pepsinen, trypsine, chymotrypsine, carboxypeptidase.
d) Amidasen - breken amidebindingen af. Voorbeelden: arginase, urease, glutaminase, enz. Veel amidase-enzymen worden aangetroffen in de ornithinecyclus.
4. LiAZ's zijn enzymen die vergelijkbaar zijn in functie van hydrolasen, maar water wordt niet uitgegeven in het splitsen van bindingen in moleculen. Enzymen van deze klasse hebben altijd een niet-eiwitgedeelte in hun samenstelling, bijvoorbeeld in de vorm van vitamine B1 of B6.
a) Decarboxylase. Deze enzymen werken op de C - C-binding. Voorbeelden omvatten glutamaatdecarboxylase of pyruvaatdecarboxylase.
b) Hydratasen en dehydratasen zijn enzymen die de splitsingreactie van C-O-bindingen katalyseren.
c) Amidin-lyasen - vernietig C-N-bindingen. Voorbeeld: argininesuccinaatlyase.
d) Р-О лиаз. Dergelijke enzymen splitsen in de regel de fosfaatgroep van de substraatstof. Voorbeeld: adenylaatcyclase.

Biochemie van enzymen op basis van hun structuur
De mogelijkheden van elk enzym worden bepaaldindividu, alleen zijn karakteristieke structuur. Elk enzym is in de eerste plaats eiwit en de structuur en mate van vouwen spelen een cruciale rol bij het bepalen van zijn functie.
Elke biokatalysator wordt gekenmerkt door de aanwezigheid van een actief centrum, dat op zijn beurt is verdeeld in verschillende onafhankelijke functionele gebieden:
1) Het katalytische centrum is een speciaal gebied.eiwit, wat de toevoeging van het enzym aan het substraat is. Afhankelijk van de conformatie van het eiwitmolecuul kan het katalytische centrum een verscheidenheid aan vormen aannemen die op dezelfde manier met het substraat moeten overeenkomen als het vergrendelen van de sleutel. Deze complexe structuur verklaart het feit dat het enzymatische eiwit zich in een tertiaire of quarternaire toestand bevindt.
2) Adsorptiecentrum - vervult de rol"Holder". Hier is het eerste dat gebeurt de binding tussen het enzymmolecuul en het substraatmolecuul. De verbindingen gevormd door het adsorptiecentrum zijn echter erg zwak, wat betekent dat de katalytische reactie in dit stadium omkeerbaar is.
3) Allosteric centra kunnen worden gevondenzowel in het actieve centrum als over het gehele oppervlak van het enzym als geheel. Hun functie is de regulatie van het enzym. Regulatie vindt plaats met remmermoleculen en activatormoleculen.
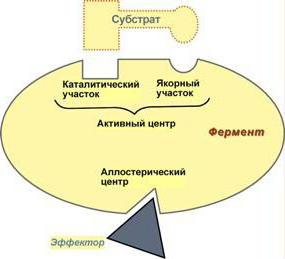
Activator-eiwitten door binding aan het molecuulenzym, zijn werk versnellen. Remmers daarentegen remmen de katalytische activiteit en dit kan op twee manieren plaatsvinden: ofwel bindt het molecuul aan het allosterische centrum in het gebied van het actieve centrum van het enzym (competitieve remming), of het sluit zich aan op een ander eiwitregio (niet-competitieve remming). Concurrerende remming wordt als effectiever beschouwd. Dit sluit tenslotte de plaats voor de binding van het substraat met het enzym, en dit proces is alleen mogelijk in het geval van bijna volledig samenvallen van de vorm van het remmermolecuul en het actieve centrum.
Een enzym bestaat vaak niet alleen uit aminozuren,maar ook van andere organische en anorganische stoffen. Dienovereenkomstig wordt het apoenzym geïsoleerd - het eiwitdeel, het co-enzym - het organische deel en de co-factor - het anorganische deel. Het co-enzym kan worden vertegenwoordigd door ulgevodami, vetten, nucleïnezuren, vitamines. De cofactor is op zijn beurt meestal hulp-metaalionen. De activiteit van enzymen wordt bepaald door de structuur: de extra stoffen in de samenstelling veranderen de katalytische eigenschappen. Verschillende soorten enzymen zijn het resultaat van het combineren van alle opgesomde factoren van complexe formatie.

Regulatie van enzymen
Enzymen als biologisch actieve stoffen zijn dat nietaltijd nodig door het lichaam. De biochemie van enzymen is zodanig dat ze een levende cel kunnen beschadigen in het geval van overmatige katalyse. Om de schadelijke effecten van enzymen op het lichaam te voorkomen, is het noodzakelijk om hun werk op de een of andere manier te reguleren.
Omdat enzymen van nature eiwit zijn, worden ze bij hoge temperaturen gemakkelijk vernietigd. Het proces van denaturatie is omkeerbaar, maar kan het werk van stoffen aanzienlijk beïnvloeden.
pH speelt ook een belangrijke rol bij de regulatie. De hoogste activiteit van enzymen wordt in de regel waargenomen bij neutrale pH-waarden (7,0-7,2). Er zijn ook enzymen die alleen werken in een zure omgeving of alleen in alkalisch. Aldus wordt in cellysosomen een lage pH gehandhaafd, waarbij de activiteit van hydrolytische enzymen maximaal is. In het geval van accidentele afgifte in het cytoplasma, waar de omgeving dichter bij neutraal is, zal hun activiteit afnemen. Een dergelijke bescherming tegen "zelfetende" is gebaseerd op de eigenaardigheden van hydrolase-werking.
Het is het vermelden waard het belang van co-enzym en co-factor in de samenstelling van enzymen. De aanwezigheid van vitamines of metaalionen beïnvloedt de werking van sommige specifieke enzymen aanzienlijk.

Nomenclatuur van enzymen
Alle enzymen van het lichaam worden opgeroepenafhankelijk van hun aansluiting bij een van de klassen, maar ook op het substraat waarmee ze reageren. Soms worden volgens de systematische nomenclatuur in de titel niet één maar twee substraten gebruikt.
Voorbeelden van de naam van sommige enzymen:
- Enzymen van de lever: lactaat dehydrogen-ase, glutamaat dehydrogen-ase.
- De volledige systematische naam van het enzym: lactaat-NAD + -oxidoreduct-ase.
Bewaarde en triviale namen die niet voldoen aan de regels van de nomenclatuur. Voorbeelden zijn spijsverteringsenzymen: trypsine, chymotrypsine, pepsine.
Enzym syntheseproces
De functies van enzymen worden op genetisch niveau bepaald. Omdat het molecuul grotendeels een eiwit is, herhaalt zijn synthese precies de processen van transcriptie en translatie.
De synthese van enzymen is als volgt. Eerst wordt informatie over het noodzakelijke enzym uit het DNA gelezen, wat resulteert in de vorming van mRNA. Matrix-RNA codeert voor alle aminozuren waaruit het enzym bestaat. De regulatie van enzymen kan ook op het DNA-niveau plaatsvinden: als het product van de gekatalyseerde reactie voldoende is, stopt de transcriptie van het gen en omgekeerd, als er een behoefte ontstaat voor het product, wordt het transcriptieproces geactiveerd.
Nadat het mRNA is vrijgegeven in het cytoplasma van de cel,De volgende fase begint - vertaling. Op de ribosomen van het endoplasmatisch reticulum wordt een primaire keten gesynthetiseerd, bestaande uit aminozuren gekoppeld door peptidebindingen. Het eiwitmolecuul in de primaire structuur kan echter nog steeds niet zijn enzymatische functies uitvoeren.
De activiteit van enzymen hangt af van de structuur van het eiwit. Bij dezelfde EPS treedt eiwit-twisting op, hetgeen resulteert in de vorming van een secundaire en vervolgens een tertiaire structuur. De synthese van sommige enzymen stopt al in dit stadium, maar de activering van de katalytische activiteit vereist vaak de toevoeging van co-enzym en cofactor.
In bepaalde delen van het endoplasmatisch reticulumDe organische bestanddelen van het enzym worden toegevoegd: monosacchariden, nucleïnezuren, vetten, vitamines. Sommige enzymen kunnen niet werken zonder co-enzym.
Cofactor speelt een cruciale rol in het onderwijsquaternaire eiwitstructuur. Sommige enzymfuncties zijn alleen beschikbaar als een eiwit een domeinorganisatie bereikt. Daarom is het erg belangrijk voor hen om een quaternaire structuur te hebben waarin het metaalion de verbindende schakel is tussen verschillende eiwitbolletjes.

Multiple Enzyme Forms
Er zijn situaties waarin de aanwezigheid vanverschillende enzymen katalyseren dezelfde reactie, maar verschillen in sommige parameters van elkaar. Het enzym kan bijvoorbeeld werken bij 20 graden, maar bij 0 graden zal het niet meer in staat zijn om zijn functies uit te voeren. Wat moet een levend organisme doen in een vergelijkbare situatie bij lage temperaturen?
Dit probleem wordt gemakkelijk opgelost door de aanwezigheid van verschillende enzymen die dezelfde reactie katalyseren, maar in verschillende omstandigheden werken. Er zijn twee soorten veelvoudige vormen van enzymen:
- Iso-enzymen. Dergelijke eiwitten worden gecodeerd door verschillende genen, bestaan uit verschillende aminozuren, maar katalyseren dezelfde reactie.
- Ware meervoudsvormen. Deze eiwitten worden getranscribeerd uit hetzelfde gen, maar peptidemodificatie vindt plaats op de ribosomen. Bij de uitgang worden verschillende vormen van hetzelfde enzym verkregen.
Dientengevolge wordt het eerste type meervoudige vormen gevormd op genetisch niveau, wanneer de tweede post-translationeel is.
Enzym waarde
Het gebruik van enzymen in de geneeskunde komt neer opde introductie van nieuwe geneesmiddelen, waarbij de stoffen al in de juiste hoeveelheden zitten. Wetenschappers hebben nog geen manier gevonden om de synthese van de ontbrekende enzymen in het lichaam te stimuleren, maar tegenwoordig zijn medicijnen die tijdelijk hun tekorten kunnen compenseren wijdverspreid.
Verschillende enzymen in de cel katalyseren groothet aantal reacties in verband met het onderhoud van het leven. Eén van dergelijke enismen is representatie van de nucleasegroep: endonucleasen en exonucleasen. Hun taak is om een constant niveau van nucleïnezuren in de cel te behouden en om beschadigd DNA en RNA te verwijderen.
Vergeet niet het fenomeen vanbloedstolling. Als een effectieve beschermingsmaatregel wordt dit proces gecontroleerd door een aantal enzymen. De belangrijkste hiervan is trombine, dat inactief fibrinogeen eiwit omzet in actief fibrine. De draden vormen een soort netwerk dat de site van schade aan het vat verstopt, waardoor overmatig bloedverlies wordt voorkomen.
Enzymen worden gebruikt bij het maken van wijn, brouwen,veel zuivelproducten ontvangen. Gist kan worden gebruikt om alcohol uit glucose te verkrijgen, maar een extract ervan is voldoende voor een succesvol verloop van dit proces.

Interessante feiten die je nog niet wist
- Alle lichaamsenzymen hebben een enorme massa -van 5.000 tot 1.000.000 Da. Dit komt door de aanwezigheid van eiwit in de samenstelling van het molecuul. Ter vergelijking: de moleculaire massa van glucose is 180 Ja, en koolstofdioxide is slechts 44 Ja.
- Tot op heden zijn meer dan 2000 enzymen ontdekt die zijn gevonden in de cellen van verschillende organismen. De meeste van deze stoffen zijn echter nog niet volledig begrepen.
- Enzymactiviteit wordt gebruikt om te verkrijgeneffectieve waspoeders. Hier vervullen enzymen dezelfde rol als in het lichaam: ze vernietigen organische stoffen en deze eigenschap helpt bij het bestrijden van vlekken. Het wordt aanbevolen om een vergelijkbaar wasmiddel te gebruiken bij een temperatuur niet hoger dan 50 graden, anders kan het denatureringsproces gaan.
- Volgens statistieken lijden 20% van de mensen overal ter wereld aan een gebrek aan een van de enzymen.
"Ze wisten al heel lang over de eigenschappen van enzymen, maar pas in 1897 begrepen mensen dat het niet de gist zelf was die gebruikt kon worden om suiker tot alcohol te fermenteren, maar een extract uit hun cellen.






