Internationale nomenclatuur van alkanen. Alkans: structuur, eigenschappen
Het is handig om te beginnen met de definitie vanalkanen. Dit zijn verzadigde of verzadigde koolwaterstoffen, paraffinen. Er kan ook worden gezegd dat dit koolstoffen zijn waarbij de verbinding van C-atomen wordt uitgevoerd door eenvoudige bindingen. De algemene formule is: CnH₂n + 2.
Het is bekend dat de verhouding van het aantal H- en C-atomenin hun moleculen zoveel mogelijk in vergelijking met andere klassen. Vanwege het feit dat alle valenties bezet zijn door C of H, zijn de chemische eigenschappen van alkanen niet duidelijk uitgedrukt, daarom is de tweede naam de combinatie van verzadigde of verzadigde koolwaterstoffen.
Er is ook een meer oude naam die het best hun chemische structuur weergeeft - paraffines, wat betekent "verstoken van affiniteit".
Het onderwerp van ons gesprek van vandaag is dus: "Alkans: homologe reeksen, nomenclatuur, structuur, isomerie". Er zullen ook gegevens zijn met betrekking tot hun fysieke eigenschappen.
Alkanes: structuur, naamgeving
In hen zijn de C-atomen in een dergelijke staatsp3-hybridisatie. In dit opzicht kan het alkaanmolecuul worden gedemonstreerd als een set van tetrahedrische C-structuren, die niet alleen onderling, maar ook met H. zijn verbonden.

Tussen de C- en H-atomen zijn er sterke, zeers-communicatie met lage polariteit. Atomen rond eenvoudige bindingen roteren altijd, daarom nemen moleculen van alkanen verschillende vormen aan, met de bindingslengte, waarbij de hoek daartussen constant is. Vormen die in elkaar worden omgezet vanwege de rotatie van een molecuul dat optreedt rond σ-bindingen worden gewoonlijk de conformaties genoemd.

In het proces van scheiding van het H-atoom van de beschouwdemoleculen vormen 1 -waardige deeltjes die koolwaterstofradicalen worden genoemd. Ze verschijnen als gevolg van verbindingen niet alleen organische stoffen, maar ook anorganisch. Als u 2 waterstofatomen wegneemt uit een verzadigde koolwaterstofmolecule, krijgt u tweevoudige radicalen.
Aldus kan de nomenclatuur van alkanen zijn:
- radiaal (oude versie);
- vervanging (internationaal, systematisch). Het wordt voorgesteld door IUPAC.
Kenmerken van de radiale naamgeving
In het eerste geval wordt de alkane nomenclatuur als volgt gekenmerkt:
- In beschouwing nemen van koolwaterstoffen als derivaten van methaan, waarbij 1 of verscheidene H-atomen zijn gesubstitueerd door radicalen.
- Hoge mate van gemak in het geval van niet erg complexe verbindingen.
Kenmerken van de vervangende nomenclatuur
De vervangende nomenclatuur van alkanen heeft de volgende kenmerken:
- De basis voor de naam is 1 koolstofketen, de resterende moleculaire fragmenten worden beschouwd als substituten.
- Als er verschillende identieke radicalen zijn, wordt een getal voor hun naam aangegeven (in strikt geschreven woorden) en worden de radicale getallen gescheiden door komma's.
Chemie: Alkane nomenclatuur
Gemakshalve wordt de informatie gepresenteerd in tabelvorm.
Naam van de stof | Basisnaam (root) | Moleculaire formule | Naam van de koolstofsubstituent | Formule koolstof substituent |
methaan | meth | CH₄ | methyl | CH₃ |
ethaan | etno | C₂H₆ | ethyl | C₂H₅ |
propaan | stutten | C₃H₈ | propyl | C₃H₇ |
butaan | maar- | C₄H₁₀ | butyl | C₄H₉ |
pentaan | luifel | C₅H₁₂ | pentyl | C₅H₁₁ |
hexaan | hex | C₆H₁₄ | hexyl | C₆H₁₃ |
heptaan | hept | C₇H₁₆ | heptyl | C₇H₁₅ |
octaan | oktober | C₈H₁₈ | octyl | C₈H₁₇ |
nonaan | n op | C₉H₂₀ | nonyl | C₉H₁₉ |
decaan | dextran | C₁₀H₂₂ | decyl | C₁₀H₂₁ |
De bovenstaande nomenclatuur van alkanen omvat namen die zich historisch hebben ontwikkeld (de eerste 4 leden van een aantal verzadigde koolwaterstoffen).
Namen van niet-gebruikte alkanen met 5 of meerC-atomen zijn afgeleid van Griekse cijfers, die een gegeven aantal C-atomen weergeven, dus het achtervoegsel -een geeft aan dat de stof uit een aantal verzadigde verbindingen bestaat.

Bij het samenstellen van de namen van ingezette alkanen inde rol van de hoofdketen is degene die het maximale aantal C-atomen bevat, het is genummerd zodat de substituenten het laagste aantal hebben. In het geval van twee of meer ketens van dezelfde lengte, wordt de hoofdketen degene die het grootste aantal substituenten bevat.
Alkane isomerie
Als een pionier koolwaterstof-seriemethaan staat voor CH выступает. Bij elke volgende vertegenwoordiger van de methaanreeks is er een verschil met de vorige door de methyleengroep - CH₂. Dit patroon kan door de reeks alkanen worden getraceerd.
De Duitse wetenschapper Shil heeft een voorstel ingediend om deze serie homoloog te noemen. Vertaald uit het Grieks betekent "vergelijkbaar, vergelijkbaar".
De homologe reeks is dus de verzamelingverwante organische verbindingen met hetzelfde type structuur met nauwe chemische eigenschappen. Homologen zijn lid van deze serie. Het homologe verschil is de methyleengroep, waardoor de twee naburige homologen verschillen.
Zoals eerder vermeld, de samenstelling van eenverzadigde koolwaterstof kan worden uitgedrukt met de algemene formule CnH₂n + 2. Het lid van de homologe reeks na methaan is dus ethaan - C₂H₆. Om zijn structuur af te leiden van methaan, is het noodzakelijk om 1 H-atoom te vervangen door CH₃ (figuur hieronder).

De structuur van elke volgende homoloog kan op dezelfde manier uit de vorige worden afgeleid. Als gevolg hiervan wordt propaan gevormd uit ethaan - C₃H₈.
Wat zijn isomeren?
Dit zijn stoffen die identiek zijnkwalitatieve en kwantitatieve moleculaire samenstelling (identieke molecuulformule), echter, verschillende chemische structuur, evenals met verschillende chemische eigenschappen.
De bovenstaande koolwaterstoffen verschillen ineen parameter zoals kookpunt: -0,5 ° - butaan, -10 ° - isobutaan. Dit type isomerie wordt koolstofskelet-isomerie genoemd, het verwijst naar het structurele type.
Het aantal structurele isomeren groeit snelsnelheden met toenemende hoeveelheden koolstofatomen. Dus, C₁₀H₂₂ komt overeen met 75 isomeren (niet inclusief ruimtelijk), en 4347 isomeren zijn al bekend voor C₁₅H₃₂, voor C₂₀H₄₂ - 366,319.
Het is dus al duidelijk geworden wat alkanen zijn, homologe reeksen, isomerie, nomenclatuur. Nu is het noodzakelijk om naar de regels voor de compilatie van namen door IUPAC te gaan.

IUPAC-nomenclatuur: regels voor het vormen van namen
Eerst moet je in koolwaterstof vindende structuur van de koolstofketen, die de langste is en het maximum aantal substituenten bevat. Vervolgens is het nodig om de atomen van de C-keten te nummeren, te beginnen vanaf het uiteinde waar de substituent het dichtst in de buurt is.
Ten tweede is de basis de naam van een onvertakte verzadigde koolwaterstof, waarbij de hoofdketen overeenkomt met het aantal C-atomen.
Ten derde, vóór de basis, moet u de nummers van de locanten opgeven, in de buurt waar de afgevaardigden zich bevinden. Ze zijn geschreven met een koppelteken achter de namen van de afgevaardigden.
Ten vierde, in geval van identiekeSubstituenten op verschillende C-atomen, de cobants worden gecombineerd, waarbij de naam een vermenigvuldigend prefix wordt: di voor twee identieke substituenten, drie voor drie, tetra voor vier, penta voor vijf, enz. De getallen moeten van elkaar worden gescheiden door een komma, en van de woorden - een koppelteken.
Als hetzelfde C-atoom twee substituenten tegelijk bevat, wordt de locant ook twee keer opgenomen.
Volgens deze regels wordt de internationale nomenclatuur van alkanen gevormd.

Newman's projecties
Deze Amerikaanse wetenschapper stelde speciale projectieformules voor, de projecties van Newman, voor de grafische demonstratie van conformaties. Ze komen overeen met de vormen A en B en worden weergegeven in de onderstaande afbeelding.
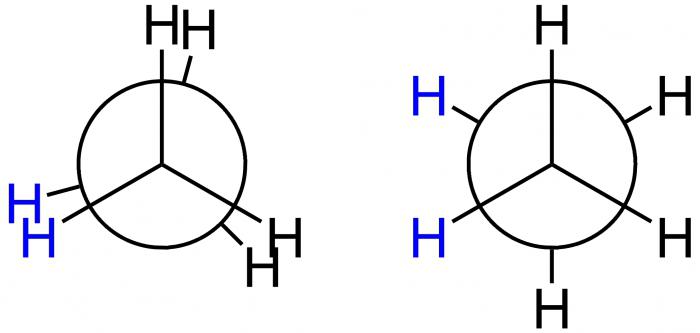
In het eerste geval is dit de A-afgeschermde vorm, enin de tweede - B-geremd. In positie A bevinden de H-atomen zich op een minimale afstand van elkaar. Deze vorm komt overeen met de hoogste energiewaarde, vanwege het feit dat de afstoting tussen hen het grootst is. Dit is een energetisch ongunstige toestand, waardoor het molecuul de neiging heeft om het te verlaten en naar een meer stabiele positie B te gaan. Hier zijn de H-atomen zo ver mogelijk van elkaar verwijderd. Het energieverschil van deze posities is dus 12 kJ / mol, waardoor de vrije rotatie rond de as in het ethaanmolecuul, dat de methylgroepen verbindt, ongelijk is. Na in een energetisch gunstige positie te vallen, wordt het molecuul daar vertraagd, met andere woorden, het is "geremd". Dat is waarom het geremd wordt genoemd. Het resultaat - 10 duizend moleculen ethaan blijven in de geremde vorm van de conformatie onder de conditie van kamertemperatuur. Slechts één heeft een andere vorm - verduisterd.
Verkrijgen van verzadigde koolwaterstoffen
Uit het artikel is al bekend dat dit alkanen zijn.(structuur, nomenclatuur daarvan eerder in detail beschreven). Het zou nuttig zijn na te denken over manieren om ze te verkrijgen. Ze onderscheiden zich van natuurlijke bronnen zoals olie, aardgas, steenkool en steenkool. Synthetische methoden worden ook gebruikt. Bijvoorbeeld H₂ 2H₂:
- Het hydrogeneringsproces van onverzadigde koolwaterstoffen: CnH₂n (alkenen) → CnH₂n + 2 (alkanen) ← CnH₂n-2 (alkynes).
- Uit een mengsel van monoxide C en H - synthesegas: nCO + (2n + 1) H₂ → CnH₂n + 2 + nH₂O.
- Van carbonzuren (hun zouten): elektrolyse aan de anode, aan de kathode:
- Kolbe-elektrolyse: 2RCOONa + 2H₂O → R-R + 2CO₂ + H₂ + 2NaOH;
- Dumas-reactie (legering met alkali): CH₃COONa + NaOH (t) → CH₄ + Na₂CO₃.
- Olie barst: CnH₂n + 2 (450-700 °) → CmH₂m + 2 + Cn-mH₂ (n-m).
- Vergassing van brandstof (vast): C + 2H₂ → CH₄.
- Synthese van complexe alkanen (halogeenderivaten) met een lager aantal C-atomen: 2CH₃Cl (chloormethaan) + 2Na → CH₃ - CH₃ (ethaan) + 2NaCl.
- Waterontleding van methaniden (metaalcarbiden): Al₄C₃ + 12H₂O → 4Al (OH₃) ↓ + 3CH₄ ↑.
Fysische eigenschappen van verzadigde koolwaterstoffen
Voor het gemak zijn de gegevens gegroepeerd in een tabel.
formule | alkaan | Smeltpunt in ° C | Kookpunt in ° C | Dichtheid, g / ml |
CH₄ | methaan | -183 | -162 | 0,415 op t = -165 ° C |
C₂H₆ | ethaan | -183 | -88 | 0,561 op t = -100 ° C |
C₃H₈ | propaan | -188 | -42 | 0,583 bij t = -45 ° C |
n-C₄H₁₀ | n-Butaan | -139 | -0,5 | 0,579 bij t = 0 ° C |
2-methylpropaan | - 160 | - 12 | 0,557 bij t = -25 ° C | |
2,2-dimethyl-propaan | - 16 | 9,5 | 0,613 | |
n-C₅H₁₂ | n-pentaan | -130 | 36 | 0,626 |
2-methylbutaan | - 160 | 28 | 0,620 | |
n-C₆H₁₄ | n-Hexaan | - 95 | 69 | 0,660 |
2-methylpentaan | - 153 | 62 | 0,683 | |
n-C₇H₁₆ | n-Heptaan | - 91 | 98 | 0,683 |
n-C₈H₁₈ | n-octaan | - 57 | 126 | 0,702 |
2,2,3,3-tetra-methylbutaan | - 100 | 106 | 0,656 | |
2,2,4-trimethyl-pentaan | - 107 | 99 | 0,692 | |
n-C₉H₂₀ | n-nonaan | - 53 | 151 | 0,718 |
n-C₁₀H₂₂ | n-decaan | - 30 | 174 | 0,730 |
n-C₁₁H₂₄ | n-undecaan | - 26 | 196 | 0,740 |
n-C₁₂H₂₆ | n-dodecaan | - 10 | 216 | 0,748 |
n-C₁₃H₂₈ | n-tridecaan | - 5 | 235 | 0,756 |
n-C₁₄H₃₀ | n-tetradecaan | 6 | 254 | 0,762 |
n-C₁₅H₃₂ | n-pentadecaan | 10 | 271 | 0,768 |
n-C₁₆H₃₄ | n-hexadecaan | 18 | 287 | 0,776 |
n-C₂₀H₄₂ | n-eicosaan | 37 | 343 | 0,788 |
n-C₃₀H₆₂ | n-Triakontan | 66 | 235 bij 1 mmHg artikel | 0,779 |
n-C₄₀H₈₂ | n-Tetrakontan | 81 | 260 bij 3 mmHg Art. | |
n-C₅₀H₁₀₂ | n-Pentakontan | 92 | 420 wanneer 15 mmHg Art. | |
n-C₆₀H₁₂₂ | n-Geksakontan | 99 | ||
n-C₇₀H₁₄₂ | n-Geptakontan | 105 | ||
n-C₁₀₀H₂₀₂ | n-Gektan | 115 |
conclusie
Het artikel werd als zoiets beschouwd alsalkanen (structuur, naamgeving, isomerie, homologe reeksen, enz.). Het is een beetje verteld over kenmerken van de radiale en vervangende nomenclatuur. Beschrijft hoe alkanen kunnen worden verkregen.
Bovendien geeft het artikel in detail het volledige bereik van alkanen weer (de test kan helpen om de verkregen informatie te assimileren).




