Graden van oxidatie van arsenicum: chemische eigenschappen van arsenicum
Voordat de oxidatietoestand wordt bekekenarsenicum, zullen we zijn positie in het periodiek systeem en de kenmerken van de structuur onthullen. Laten we bovendien de fundamentele fysische en chemische eigenschappen van dit chemische element noemen.

Positie in de PS
De belangrijkste oxidatietoestanden van arseen, chemischeigenschappen, toepassing - dit alles kan worden geleerd door te kijken naar de locatie van het element in het periodieke systeem van Mendelejev. Arsenic bevindt zich in de vijfde groep, de belangrijkste subgroep, is een lid van de stikstoffamilie. Het heeft een relatieve atomaire massa van 74.9216. De belangrijkste graden van oxidatie van arsenicum zijn precies gerelateerd aan de groep waarin het zich in de SS bevindt. Dit element heeft 33 serienummer. Het aantal energieniveaus komt overeen met het nummer van de periode waarin het element zich bevindt, het is gelijk aan vier.
Overweeg de opstelling van elektronen op elkatomaire schaal. Op het eerste energieniveau zijn er slechts twee gekoppelde elektronen, de tweede omhulling wordt bezet door acht deeltjes: 2s en 6p. Op het derde niveau, afgezien van hen, zijn er tien d-elektronen, dat wil zeggen, slechts 18 deeltjes. Het externe energieniveau is een 2s-elektron, evenals drie ongepaarde p-elektronen. Het is het aantal valentie-elektronen dat de mogelijke graden van oxidatie van arseen bepaalt.
Pagina's van geschiedenis
Het is arseen toegeschreven aan de vijf "alchemistische"elementen bekend uit de Middeleeuwen. Een interessant punt is het feit dat vier van hen zich in de vijfde PS-groep bevinden. In die tijd wist niemand de graad van oxidatie van arseen te bepalen, maar de verbindingen ervan werden met succes gebruikt om medicijnen te maken, verven te maken.
Na de vervanging van het stenen tijdperk door de bronstijd, mensenheb geleerd hoe je deze legering met speciale eigenschappen kunt maken. Het bleek dat het tot 7 procent arseen en slechts 3 procent tin bevatte. Wetenschappers geloven dat bij het eerste smelten van brons in plaats van malachiet, dat groen is, per vergissing de groene sulfiden van koper-arseenmineralen zijn ingenomen.
De verbazingwekkende prestaties van de resulterende legering maakten het populair onder oude meesters. Ze hebben speciaal gezocht naar mineralen in de natuur die de substantie bevatten.
Graden van oxidatie van arseen in verbindingen van dergelijketype positief, komt overeen met de hogere valentie. Om sulfiden te identificeren die arseen bevatten, wordt het mineraal verhit. Het verschijnen van een specifieke knoflookgeur is een bevestiging van de aanwezigheid van arseen in de compound. Geleidelijk aan het smelten van arseenbrons geweigerd. Onder de redenen voor de beëindiging van de productie noemen wetenschappers de constante vergiftiging van meesters tijdens het werk.

Natuurlijke mineralen
In de vorm van een mineraal, de stof die we overwegenbekend sinds de oudheid. Bijvoorbeeld, de oxidatietoestand van 3 arseen verschijnt in een verbinding die in het oude China bekend staat als "mijnstof". Aristoteles beschreef de minerale sandarak, die een arseensulfide is. Vertaald uit het Latijn, klinkt de naam als "gouden verf". Gebruikte het in die verre tijden als een gele kleurstof.
In de elfde eeuw alchemistenverschillende soorten van deze stof. De graden van oxidatie van arseen in de verbindingen weergegeven door deze soorten komen overeen met het groepsnummer. Witte arseen noemde het zeswaardig oxide, geel werd sulfide genoemd en rood - As4S4 (tetrasulfide tetrashyyyaka).
De witte variant werd verkregen door sublimatie van onzuiverheden inhet proces van het verbranden van koperertsen, waaronder arseen. Als condensatie uit de gasvormige toestand precipiteert arseenoxide als een witte afzetting. Het wordt al sinds de oudheid gebruikt als middel om ongedierte te vernietigen.
In de dertiende eeuw, Albert de Groteeen metaalsubstantie wordt verkregen. Hij verwarmde het gele arsenicum met zeep. De substantie verkregen als resultaat van de interactie bevestigde niet de "mystieke verbinding" van de zeven metalen met de planeten. Misschien, juist vanwege de onthulde tegenstrijdigheid van de alchemisten uit de oudheid, werd arsenicum beschouwd als een "onwettig" element. Het was in die verre tijden dat zijn vermogen om koper een witte kleur te geven, waardoor hij een middel werd genoemd, "bleken Venus", werd onthuld.
Als een individuele substantie, dithet chemische element werd pas in het midden van de zeventiende eeuw geïdentificeerd. De Duitse apotheker Johann Schröder slaagde erin hem te isoleren door een chemische reductie van steenkooloxiden uit te voeren. Na enige tijd slaagde Nichola Lemery er in om het metaal te extraheren door kalium, zeep, arseenoxide te verhitten. In de 18e eeuw stond dit metaal bekend als een ongebruikelijk 'semimetaal'.
Aan het einde van de 18e eeuw de Zweedse chemicus K.V. Scheele verkreeg arseenzuur, waarin de hoogste graad van oxidatie van arseen verschijnt: +5. In de negentiende eeuw werden organische stoffen geïdentificeerd die arseen bevatten.

In de natuur zijn
De hoogste en laagste graad van oxidatie van arseenmanifesteren zich in zijn natuurlijke verbindingen. In de aardkorst is de procentuele concentratie van dit element niet groter dan 5 gram per ton. In veel mineralen zit het tegelijkertijd met nikkel, kobalt, koper, ijzer.
Op dit moment ongeveer tweehonderdverschillende natuurlijke mineralen, waaronder het chemische element dat we overwegen. Aangezien ze een hogere en lagere oxidatiegraad van arseen vertonen, hebben ze een andere toepassing. Bijvoorbeeld, in combinatie met antimoon, vertoont arseen een negatieve oxidatietoestand. Gegeven het feit dat dit metaal een lage elektronegativiteit heeft, is de laagste graad van oxidatie van arseen -3. Deze indicator is kenmerkend voor arsenides, evenals voor mineraal almontiet.
De meeste verbindingen met metalen van arsenicum, rekening houdend met de specificiteit van de samenstelling, zijn intermetallische verbindingen die verschillen in de variabele samenstelling van dit chemische element.
Kenmerkend voor arsenides
Voor arsenides is de inhoud van meerderemetalen met een vergelijkbare structuur van kristalroosters. Deze mineralen worden gekenmerkt door metaalglans, ze zijn ondoorzichtig, hebben een lichte hardheid.
Als voorbeelden van natuurlijke arseniden kunnen de volgende verbindingen worden beschouwd:
- lellingiet, vergelijkbaar met pyriet;
- nickeline, nickel red pyriet;
- langisit;
- Oregon;
- sperrylite.
Dit is natuurlijk geen volledige lijst.soortgelijke mineralen - op dit moment zijn er ongeveer vijfentwintig van dergelijke verbindingen. Een van de meest voorkomende in de natuur kan worden genoemd arsenopyrite, genaamd arseen pyriet. Het is een product dat wordt verkregen door zwavelatomen in pyriet te vervangen door arsenicum. Verbindingen van dit type, waarin de hoogste mate van arseenoxidatie niet tot uiting komt, worden sulfosalts genoemd.
Hun tegenhangers zijn kobalt glans,Gersdorfit, enargit, en ook prustit. Dit laatste is een belangrijk zilvererts gelegen in de bovenste laag van kostbare aderen. De samenstelling van sulfosalts kan edelmetalen van de platinagroep omvatten. Hiervan is belang gelijk, evenals orsit. In hun samenstelling zijn er zeldzame metalen die worden gebruikt als uitstekende katalysatoren in organische en anorganische syntheses.
De maximale oxidatiegraad van arseengemanifesteerd in zijn natuurlijke sulfiden. Bijvoorbeeld in oranjegeel dimorfiet, dat arseensulfide is (5). In de jaren dertig van de vorige eeuw werden natuurlijke afzettingen van orpiment, waaronder driewaardig arseensulfide, ontdekt in het zuiden van de Verkhoyansk Range. De grootte van de gedetecteerde kristallen bereikte een lengte van 60 centimeter en het gewicht werd geschat op 30 kilogram.

Kenmerkend voor arsenaten
Mogelijke graden van oxidatie van arseen kunnen zijnoverweeg het voorbeeld van zouten. Dus, verbindingen van arseenzuur, arsenaten genoemd, demonstreren de maximale snelheid voor dit metaal: +5. Als een voorbeeld van dergelijke verbindingen geven we erythrine, met een felroze kleur. Dit zout wordt kobaltkleur genoemd en heeft de formule Co3 (AsO4) 2 * 8H2O. Het is ook mogelijk om het gaspariet met een bruinachtige tint op te merken in de vorm van (Ce, La, Nd) ArO4.
Langbanovskys ontdekt in het centrum van Zwedenijzer-mangaan putten, waar ongeveer vijftig verschillende arsenaten werden gevonden en gekarakteriseerd. Deze verbindingen werden gevormd door de interactie van arseenzuur met mangaanhydroxide (2) bij lage temperaturen.
Wat zijn de oxidatietoestanden in arsenatenArseen? Het kenmerk van deze zouten bevestigt de aanwezigheid van zwavel daarin. Ondanks het gebrek aan industriële toepassing, laat hun esthetische verschijning ze toe om mineralogische collecties te maken.
Een interessant verhaal is Kupfernickel, datkomt overeen met de minerale nickeline. De middeleeuwse Duitse mijnwerkers noemden de berg boze geest, en het "namaakkoper" werd de "bekerforniel" genoemd. Meesters onthulden de externe gelijkenis van koperrode kristallen van dit mineraal met koperertsen. Gebruikte ze bij het maken van glas om het resulterende product een groene tint te geven. Pas in het midden van de achttiende eeuw slaagde de mineraloog Axel Kronstedt erin om nikkel uit dit mineraal te winnen.
Kenmerken van plaatsing in de natuur
Arsenicum wordt gekenmerkt door hoge inertie,daarom kan het in zijn oorspronkelijke staat worden gevonden. Een dergelijk metaal in de samenstelling heeft twee tot zestien procent onzuiverheden, voornamelijk zullen zij zilver, ijzer, kobalt, nikkel zijn. In ons land ontdekten geologen inheems arseen in de regio Amur, Transbaikalia.
Het is te vinden in rotsen, in mineralen en in planten, dus wordt het vaak het alomtegenwoordige element van rechts genoemd.
Wat is de maximale en minimale graadarseen oxidatie? De hoogste waarde komt overeen met het nummer van de groep waarin het element zich bevindt en is +5. Dit is typerend voor verbindingen waarin het reducerende eigenschappen vertoont. In meer detail zullen we later verbindingen van dit unieke metaal beschouwen.
Arseen is extreem ongelijk over de hele wereld. De reden is de vorming van de lithosfeer, evenals in de desorptie- en sorptieprocessen die plaatsvinden in afzettingsgesteenten en bodems.
Vanwege de uitstekende oplosbaarheid van dit metaal in water, migreert het gemakkelijk. In een vochtig klimaat bijvoorbeeld, wordt het uit de grond gewassen, gevolgd door beweging samen met grondwater en rivieren.

Fysiologische actie
In substantiële hoeveelheden is arseen vervat inmineraalwater. Er zijn bepaalde normen voor de inhoud van dit metaal. Als de toegestane waarden worden overschreden, is er sprake van een ernstige dreiging van schade aan het menselijk lichaam. In de loop van chemisch onderzoek werd ontdekt dat arseen in verschillende vormen in natuurlijk water kan worden gehouden. Wat moet de oxidatiegraad van arseen zijn? De eigenschappen van de verbindingen in water bevestigen de aanwezigheid van het metaal in de vorm van een oplossing van arseenzuur.
Arseen bevat ongeveer 6 mg per leven.kg. Een deel van zeewier kan de substantie in zichzelf zodanig accumuleren dat het gevaarlijk kan zijn voor het menselijk lichaam. Sommige van hun soorten in Aziatische landen kunnen zich vermenigvuldigen in een zuivere zuuroplossing. Ze worden gebruikt als een manier om met ratten om te gaan. In het hersenweefsel van een persoon, evenals in zijn spieren, is er een voldoende hoeveelheid van dit metaal. Bovendien is het aanwezig in de nagelplaten, hoopt het op in het haar.
Fysieke kenmerken
Hoewel arseen eruit zietmetaal, het heeft niet-metalen tekens. Het is bijvoorbeeld niet in staat om zouten te vormen met zwavelzuur, dat werkt als een zuurvormend element. Arseen kan bestaan in verschillende allotropische modificaties, die lijken op fosfor. De meest stabiele is grijs arseen, dat bij verhitting op dezelfde manier sublimeert als jodium.
Voor elektrische geleidbaarheid, deze wijziginginferieur aan koper, maar overschrijdt kwik. Bij het koelen van arseendamp kun je een zachte, transparante gele substantie krijgen, vergelijkbaar met gele fosfor. Tijdens het verwarmen verandert het in een andere allotrope modificatie van het chemische element.
Bij het neerslaan van arseendampen op glas, kan men het uiterlijk van een spiegelfilm waarnemen.

Arseenverbindingen
De mate van oxidatie van arseen in het hogere oxideis +5, dat wil zeggen, het komt overeen met zijn hogere valentie. Maar tijdens de sublimatie van de dampen van dit metaal in vochtige lucht, wordt een zwarte film van zijn arseenanhydride As2O gevormd.3. Het is in deze vorm dat in feite het oxide van dit element bestaat. Dit oxide vertoont amfotere chemische eigenschappen.
Tijdens het oxidatieproces verandert het in een hoger oxide, waarbij arseen de waarde van de oxidatietoestand +5 aantoont.
Zuiver metaal wordt geoxideerd met verdund salpeterzuur tot blauwzuur H3AsO3waarin het een valentie van 3 heeft. Volgens zijn chemische mogelijkheden wordt het beschouwd als een zuur met matige sterkte, vergelijkbaar met boorzuur. Zouten zijn arseniet en vertonen helder reducerende eigenschappen.
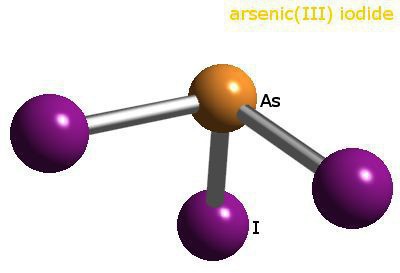
In chloride heeft het metaal een oxidatietoestand van +3,fungeert als een typisch metalen element. Zoutachtige arseniden, die worden gevormd bij wisselwerking met actieve metalen, ondergaan waterige hydrolyse. Bijvoorbeeld arsine (AsH3) is een giftig, kleurloos, geurloos gas.
Organometallische verbindingen
Arsenic kan verschillende vormenORGANOMETALLISCHE VERBINDINGEN. Aan het einde van de 18e eeuw bijvoorbeeld, toen met arseenoxide (3) kaliumacetaat werd gedestilleerd, werd een rokende vloeistof verkregen die een onaangename geur had. Het resulterende product werd alarsine genoemd. In vervolgstudies werd gevonden dat arseen aanwezig is in zijn samenstelling.
Aan het einde van de negentiende eeuw werden gesynthetiseerdaromatische arsines. De reactie werd uitgevoerd met blootstelling aan een mengsel van arseentrichloride en arylhalogenide met metallisch natrium. Sommige van deze producten vertoonden antimicrobiële eigenschappen. Tegenwoordig worden tienduizenden organo-arseenstoffen gesynthetiseerd.
Gebruik van arsenicum
Meer dan de helft van alle gewonnen metalengebruikt in de vorm van verschillende verbindingen. In zijn pure vorm wordt het praktisch niet gebruikt. In een kleine hoeveelheid wordt het in de lagerlegeringen ingebracht. Dergelijke additieven hebben een positief effect op de hardheid van het eindproduct, dus er is veel vraag naar bij de vervaardiging van elektrische kabels en batterijen.
Minimale doses arsenicum nemen toecorrosieweerstand, verbeteren de thermische prestaties van messing en koper. Als dit element geen extra onzuiverheden bevat, is het in dit geval veel gevraagd bij de vervaardiging van halfgeleiderelementen. Om ze te maken, is arseen gefuseerd met germanium of silicium.
Bovendien is het een uitstekende legeringadditief bij het maken van staal. Als waardevol mondstuk is arseen ook nodig in non-ferrometallurgie. Zelfs met zijn lage gehalte in de legering is het mogelijk om de sterkte van het gefabriceerde product aanzienlijk te vergroten. Arsenicum verhoogt de koperstroom tijdens het gieten, waardoor het verkrijgen van draad wordt vergemakkelijkt.
Er is een bepaald negatief effect van dit overgangsmetaal op de productie. Zijn aanwezigheid in het erts maakt van het proces een schadelijke productie.
Onder de diverse interessante arseenverbindingenvertegenwoordigt zijn trivalent oxide. Het wordt momenteel gebruikt bij het smelten van glas. Zouten met een indicator van +5 zijn populair als antiseptica. Dit overgangselement is een van de meest populaire in de moderne chemische productie, omdat het dubbele eigenschappen vertoont, afhankelijk van de procesomgeving.