De mate van oxidatie is welke waarde? Hoe de mate van oxidatie van elementen bepalen?
Een dergelijk onderwerp van het schoolcurriculum als scheikundeveroorzaakt tal van problemen in de meerderheid van de studenten van vandaag, konden maar weinig mensen de mate van oxidatie in de verbindingen te bepalen. Het grootste probleem bij schoolkinderen die anorganische chemie, dat wil zeggen, basisschoolleerlingen (8-9 graden) te bestuderen. Object misverstand leidt tot schoolkinderen om het onderwerp een hekel.
Leraren identificeren hiervoor een aantal redenen"Dislike" van middelbare en oudere studenten in de chemie: terughoudendheid om complexe chemische termen te begrijpen, onvermogen om algoritmen te gebruiken om een bepaald proces te overwegen, problemen met wiskundige kennis. Het ministerie van Onderwijs van de Russische Federatie heeft een grote verandering in de inhoud van het onderwerp geïntroduceerd. Bovendien, "knippen" en het aantal uren voor het lesgeven in scheikunde. Dit had een negatieve invloed op de kwaliteit van de kennis over het onderwerp, een afname van de belangstelling voor de studie van discipline.

Welke onderwerpen van de chemiecursus worden het moeilijkst gegeven voor schoolkinderen?
Onder het nieuwe programma in de loop van de academische disciplineDe "chemie" van de hoofdschool omvatte een aantal serieuze onderwerpen: periodiek systeem van de elementen van DI Mendeleyev, klassen van anorganische stoffen, ionenwisseling. Het is het meest moeilijk voor achtste klassers om de oxidatietoestand van oxiden te bepalen.
Regels van het arrangement
Allereerst moeten studenten die oxiden kennenzijn complexe verbindingen met twee elementen, waarin zuurstof is inbegrepen. Een verplichte voorwaarde dat de binaire verbinding tot de klasse van oxiden behoort, is de positie van zuurstof in de tweede verbinding in deze verbinding.
Het berekenen van een dergelijke indicator in formules van deze klasse wordt alleen verkregen als de student een bepaald algoritme heeft.
Algoritme voor zuuroxiden
Merk allereerst op dat de mate van oxidatie dat isnumerieke uitdrukkingen van valentie-elementen. Zuuroxiden worden gevormd door niet-metalen of metalen met een valentie van vier tot zeven, de tweede in dergelijke oxiden is zuurstof.
In oxiden is de zuurstofvalentie altijdkomt overeen met twee, het kan worden bepaald door het periodiek systeem der elementen van DI Mendelejev. Zo'n typisch niet-metaal als zuurstof, dat zich in de zesde groep van de hoofdsubgroep van het periodiek systeem bevindt, heeft twee elektronen nodig om zijn externe energieniveau volledig te voltooien. Niet-metalen in verbindingen met zuurstof vertonen meestal een hogere valentie, wat overeenkomt met het nummer van de groep zelf. Het is belangrijk om eraan te herinneren dat de mate van oxidatie van chemische elementen een indicator is die een positief (negatief) getal suggereert.
Niet-metaal, dat aan het begin van de formule staat, heeftpositieve oxidatietoestand. Niet-metaalzuurstof in oxiden is stabiel, de indicator is -2. Om de nauwkeurigheid van de rangschikking van waarden in zure oxiden te controleren, is het noodzakelijk om alle getallen te vermenigvuldigen met de indices van een bepaald element. Berekeningen worden als betrouwbaar beschouwd als het totale resultaat van alle voor- en nadelen van de ingestelde graden 0 is.

Compilatie van formules met twee elementen
De mate van oxidatie van atomen van elementen geeft een kansmaak en registreer verbindingen van twee elementen. Bij het maken van een formule, om te beginnen, worden beide symbolen naast elkaar voorgeschreven, de zuurstof is de tweede die wordt geplaatst. Bovenop elk van de opgenomen karakters worden de waarden van oxidatietoestanden geschreven, en tussen de gevonden nummers is het getal dat zonder residu in beide getallen wordt verdeeld. Deze indicator moet afzonderlijk worden gedeeld door de numerieke waarde van de oxidatiegraad, waarbij indices worden verkregen voor de eerste en tweede componenten van de stof met twee elementen. De hoogste graad van oxidatie is de numerieke waarde van de hogere valentie van een typisch niet-metaal, identiek aan het nummer van de groep waarin het niet-metaal zich in de PS bevindt.
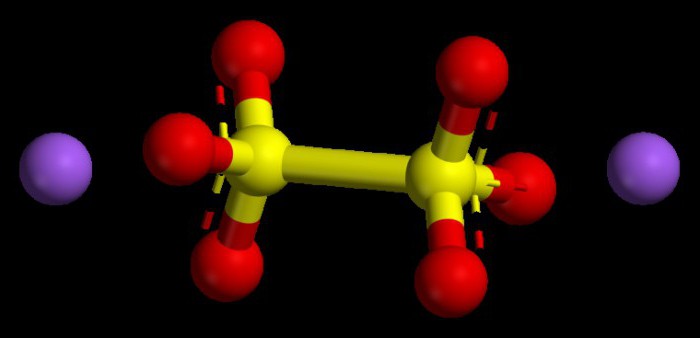
Algoritme voor het instellen van numerieke waarden in basische oxiden
Dergelijke verbindingen worden als typische oxiden beschouwd.metalen. Ze hebben in alle verbindingen een oxidatie-index van niet meer dan +1 of +2. Om te begrijpen wat de oxidatiegraad van het metaal zal zijn, kunt u het periodieke systeem gebruiken. In metalen van de hoofdsubgroepen van de eerste groep is deze parameter altijd constant, vergelijkbaar met het groepsnummer, dat wil zeggen +1.
Metalen ook van de hoofdsubgroep van de tweede groepgekenmerkt door een stabiele oxidatiegraad, numeriek +2. De oxidatiegraad van oxiden in totaal, rekening houdend met hun index (aantal), zou nul moeten geven, omdat het chemische molecuul als een neutraal, ladingvrij deeltje wordt beschouwd.
Opstelling van oxidatietoestanden in zuurstofhoudende zuren
Zuren zijn complexe stoffenbestaande uit een of meer waterstofatomen die geassocieerd zijn met een soort zuurresidu. Aangezien de oxidatietoestanden digitale indicatoren zijn, zijn enkele wiskundige vaardigheden vereist om deze te berekenen. Een dergelijke indicator voor waterstof (proton) in zuren is altijd stabiel, is +1. Vervolgens kunt u de mate van oxidatie voor een negatief zuurstofion specificeren, het is ook stabiel, -2.
Pas na deze acties kunt u berekenenoxidatietoestand van de centrale component van de formule. Als een specifiek monster beschouwen we de bepaling van de mate van oxidatie van elementen in zwavelzuur H2SO4. Gegeven dat het molecuul van deze complexe stof twee protonen van waterstof, 4 zuurstofatomen bevat, krijgen we een uitdrukking van dit type + 2 + X-8 = 0. Om een totaal van nul te vormen, heeft zwavel een oxidatietoestand van +6.
Opstelling van oxidatietoestanden in zouten
Zouten zijn complexe verbindingenbestaande uit metaalionen en een of meerdere zure resten. De methode voor het bepalen van de graden van oxidatie in elk van de bestanddelen in een complex zout is hetzelfde als in zuurstofbevattende zuren. Aangezien de mate van oxidatie van elementen een digitale indicator is, is het belangrijk om de mate van oxidatie van het metaal correct te identificeren.
Als het metaal dat het zout vormt zich bevindt inde belangrijkste subgroep, de oxidatietoestand ervan zal stabiel zijn, komt overeen met het groepsnummer, is een positieve waarde. Als het zout een metaal bevat van een vergelijkbare subgroep van PS, die verschillende valenties vertoont, is het mogelijk om de metaalvalentie door de zuurrest te bepalen. Nadat de mate van oxidatie van het metaal is vastgesteld, wordt de mate van oxidatie van zuurstof (-2) ingesteld, vervolgens wordt de mate van oxidatie van het centrale element berekend met behulp van de chemische vergelijking.
Neem als voorbeeld de definitieoxidatietoestanden van elementen in natriumnitraat (middenzout). NaNO3. Zout wordt gevormd door een metaal uit de hoofdsubgroep van groep 1, daarom zal de natriumoxidatie-graad +1 zijn. In zuurstof in nitraten is de oxidatiesnelheid -2. Om de numerieke waarde van de graad van oxidatie te bepalen, is de vergelijking + 1 + X-6 = 0. Als we deze vergelijking oplossen, vinden we dat X +5 moet zijn, dit is de mate van stikstofoxidatie.

Algemene voorwaarden in IAD
Zowel voor het oxidatieve als het reducerende proces zijn er speciale voorwaarden die studenten moeten leren.
De mate van oxidatie van een atoom is het directe vermogen om elektronen van sommige ionen of atomen aan zichzelf te hechten (geven aan anderen).
Neutrale atomen of geladen ionen worden als een oxidatiemiddel beschouwd, elektronen worden tijdens een chemische reactie aan zichzelf gehecht.
Ongeladen atomen of geladen ionen worden het reductiemiddel, die in het proces van chemische interactie hun eigen elektronen verliezen.
Oxidatie wordt voorgesteld als een procedure voor het vrijkomen van elektronen.
De reductie is het gevolg van de acceptatie van extra elektronen door een ongeladen atoom of ion.
Redox-procesgekenmerkt door een reactie, waarbij de oxidatietoestand van een atoom noodzakelijkerwijs verandert. Met deze definitie kunt u begrijpen hoe u kunt bepalen of de reactie IAD is.

OVR-ontleedregels
Met dit algoritme kunt u de coëfficiënten in elke chemische reactie plaatsen.
Eerst moet je in elke chemische stof plaatsenoxidatietoestand. Merk op dat in een eenvoudige stof de oxidatiegraad nul is, omdat er geen terugslag (hechting) van negatieve deeltjes is. De regels voor de rangschikking van oxidatietoestanden in binaire en drie-elementsubstanties zijn hierboven besproken.
Vervolgens is het noodzakelijk om die atomen of ionen te bepalen, die in de loop van de transformatie plaatsvonden, de mate van oxidatie veranderde.
Van de linkerkant van de geschreven vergelijking isatomen of geladen ionen die hun oxidatietoestand hebben veranderd. Het is noodzakelijk om een balans op te stellen. Boven de elementen moeten hun waarden staan.
Vervolgens zijn die atomen of ionen datgevormd tijdens de reactie, aangegeven door het teken + aantal elektronen aanvaard door het atoom, - het aantal weggegeven negatieve deeltjes. Als na het proces van interactie de oxidatietoestand afneemt. Dit betekent dat de elektronen zijn ingenomen door het atoom (ion). Met een toename in de mate van oxidatie geeft een atoom (ion) tijdens de reactie elektronen af.
Het kleinste totale aantal wordt eerst gedeeld door de ontvangen, vervolgens door de elektronen weggegeven in het proces, en coëfficiënten worden verkregen. De gevonden aantallen zijn de gewenste stereochemische coëfficiënten.
Bepaal het oxidatiemiddel, reductiemiddel, de processen die plaatsvinden tijdens de reactie.
De laatste stap is de plaatsing van stereochemische coëfficiënten in de betreffende reactie.
Voorbeeld iad
Overweeg de praktische toepassing van dit algoritme op een specifieke chemische reactie.
Fe + CuSO4 = Cu + FeSO4
We berekenen indicatoren voor alle eenvoudige en complexe stoffen.
Omdat Fe en Cu eenvoudige stoffen zijn, is hun oxidatietoestand gelijk aan 0. In CuSO4, Cu + 2, dan in zuurstof-2 en in zwavel +6. In FeSO4: Fe + 2, dus voor O-2, volgens berekeningen S + 6.
Nu zijn we op zoek naar elementen die indicatoren kunnen veranderen, in onze situatie zullen ze Fe en Cu zijn.
Sinds na de reactie de waarde van het atoom van ijzerwerd +2, in de reactie werden 2 elektronen gegeven. Koper veranderde zijn prestaties van +2 naar 0, daarom nam koper 2 elektronen in beslag. Nu bepalen we het aantal ontvangen en gegeven elektronen door het ijzeratoom en het tweewaardige koper-kation. In de loop van de transformatie werden twee elektronen genomen door het tweewaardige koper-kation, hetzelfde aantal elektronen werd weggegeven door een ijzeratoom.
In dit proces heeft het geen zin om te definiërenhet minimale gemene veelvoud, omdat een gelijk aantal elektronen wordt geaccepteerd en wordt weggegeven tijdens de transformatie. De stereochemische coëfficiënten komen ook overeen met één. In de reactie zijn de eigenschappen van het reductiemiddel ijzer, terwijl het wordt geoxideerd. Het tweewaardige koper-kation wordt tot puur koper gereduceerd, in de reactie heeft het de hoogste oxidatiegraad.

Procesaanvraag
Oxidatieformules moeten bekend zijnelke student in groep 8-9, omdat deze vraag deel uitmaakt van de OGE-opdrachten. Alle processen die plaatsvinden met oxidatieve, afnemende tekenen spelen een belangrijke rol in ons leven. Zonder hen zijn metabolische processen in het menselijk lichaam onmogelijk.